| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2004年5月26日 |
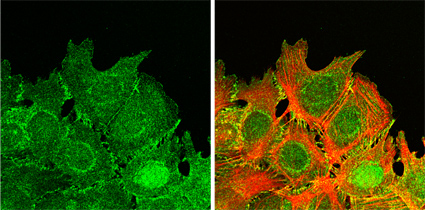
アクチンフィラメントは細胞骨格の一種で、細胞内に網目状構造を形成し、細胞の形態構築とその安定性に関与している。同時に、細胞内外からのシグナルに応答して再編成され、細胞構造を動的にし、細胞運動にも関わる。細胞外からのシグナルは、細胞膜上のチャネルや受容体によって認識されるが、細胞接着分子として知られるカドヘリンファミリーも受容体として機能し、細胞内のシグナル伝達に関与する事が明らかになりつつある。高次構造形成研究グループの田ノ上(基礎科学特別研究員)らは今回の研究で、Fatカドヘリンがアクチンの動態に直接的に関わっていることを明らかにした。 カドヘリンは細胞接着に関与する古典的なカドヘリンを含むスーパーファミリーを形成し、さらに様々な機能をもつサブファミリーに分ける事ができる。Fatカドヘリンは最も分子量が大きく、古典的なカドヘリンの約7倍もの長さの細胞外ドメインをもつ。Fatカドヘリンの細胞外ドメインは腎糸球体などの細胞接着において、細胞間の距離の調節に関与していると考えられている。また、Fatカドヘリンは古典的なカドヘリンとはかなり異なる細胞内ドメインをもち、細胞認識や接着とは別の機能をもつ事も予想されている。 田ノ上らはFatカドヘリンの機能を解明するために、まず、哺乳類のFat1の局在解析を行った。その結果、数種の細胞において糸状仮足や膜状仮足、細胞接触領域にFat1の発現が見られた。彼らはFat1が細胞内の極めて動的な部位に局在していることに興味を持ち、Fatとアクチンフィラメントとの関連を調べた。
RNAiによるFat1のノックダウン解析では、Fat1が正常な細胞結合の形成と維持に必要であるのみならず、アクチンの適切な重合にも必要であることを突き止めた。また、Fat1は損傷を受けた組織の細胞が極性を獲得するのに必要であることが明らかになった。 また、Fat1の細胞質ドメインは、アクチンストレスファイバーの形成を誘導するが、Ena/VASP結合部位を欠くFat1を発現する細胞では、この活性が抑制されることから、Fat1はEna/VASPを介してアクチンの動態を制御している事が示唆された。さらに、Fat1のノックダウン解析では、種々のタイプのアクチン骨格の形成が著しく阻害されることが明らかとなった。 田ノ上らはこれらの研究成果を5月24日付けのJournal of Cell Biologyで発表し、最もよく解析された細胞骨格分子といえるアクチンの動態とFatカドヘリンとの新たな関係について報告している。 |
|||||
|
|||||
[ お問合せ:独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター 広報国際化室 ] |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |