| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2005年3月25日 |
非対称細胞分裂は多細胞生物の発生に必須のプロセスである。発生は受精卵の卵割に始まり、最初はほぼ均一な細胞の集団を形成するが、ある段階から様々な種類の細胞が生じ、多様な組織が形成されていく。これは、細胞分裂によって生じた2つの娘細胞が異なる細胞運命をたどる「非対称細胞分裂」のおかげである。逆に言えば、非対称細胞分裂が起きなければ、胚は単一の種類の細胞からなるただの細胞塊になってしまう。 例えば、ショウジョウバエでは、神経幹細胞の非対称細胞分裂により、娘細胞の一方にのみProsperoと呼ばれる転写因子が分配され、これにより神経母細胞への運命を決定付けられる。Prosperoを受け取らなかったもう一方の娘細胞は、神経幹細胞としての性質を維持し、引き続き自己複製と神経母細胞の産生を行う。線虫C.elegansの発生においても、非対称細胞分裂は様々な場面で決定的な役割を担っているが、今回の研究はT細胞系列の分化のメカニズムに新たな知見を加えた。 細胞運命研究チームの澤斉チームリーダーらは、転写制御複合体の構成成分と予測されるLET-19及びDPY-22が、T細胞系列の非対称細胞分裂に必要であることを明らかにした。これらの分子は、Wntシグナルの標的遺伝子を転写不活性化することで、T細胞系列の細胞分裂に非対称性を与えていると考えられる。この研究は大阪大学、神戸大学及び慶応大学との共同で行われ、Development誌に3月25日付で発表された。
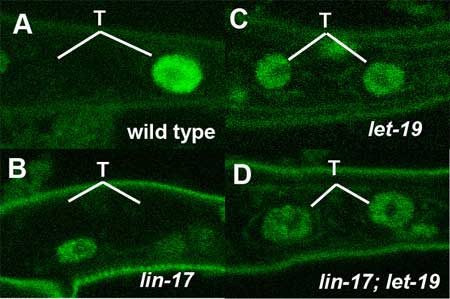
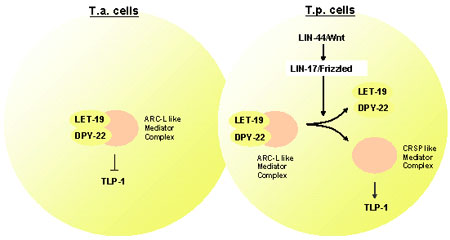
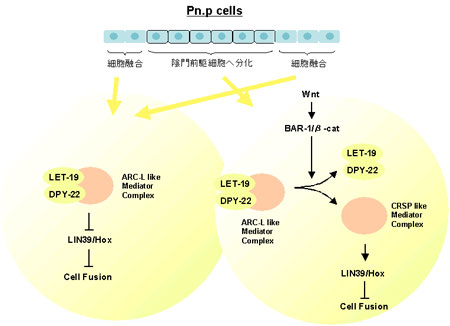
線虫では、多くの非対称細胞分裂がWntシグナルによって制御されていることが以前より知られている。T細胞の分裂においても、TLP-1と呼ばれる分子が、Wntシグナルの制御により、2つの娘細胞に不均等に発現していることが最近報告されていた。また、lin-17/frizzled及びlin-44/wntの欠損はT細胞の非対称細胞分裂を阻害し、結果としてT.p.細胞から生じるはずのphasmid socket cellを欠損することが示されている。しかし、Wntシグナルが標的遺伝子の転写をどのように制御し、非対称分裂を実現しているのかは明らかになっていなかった。 澤チームリーダーらは、phasmid socket cellを欠損する表現型を解析する過程で、let-19およびdpy-22を同定した。これらの遺伝子を欠損する変異体では、lin-17を欠損した場合と同様に、T細胞の分裂が非対称ではなく対称になっていることが示された。let-19及びdpy-22がどのように非対称分裂を実現しているのかを解明するために、T細胞の娘細胞であるT.a.細胞及びT.p.細胞に非対称に発現する2つの遺伝子、pop-1及びtlp-1との関係を調べた。通常、T.p.細胞ではpop-1遺伝子の局在がWntシグナルにより抑制されている。彼らは、GFPとの融合によりPOP-1の局在解析を行ったところ、let-19およびdpy-22のいずれを欠損しても、POP-1の局在に変化は見られなかった。つまり、let-19及びdpy-22がPOP-1の局在を制御している可能性は否定された。次に彼らは、T細胞の非対称分裂に必要とされるtlp-1の解析を行った。TLP-1はWntシグナルの下流で機能する転写因子で、T.p.細胞のみで発現していることが知られる。まず、lin-17の変異体を調べたところ、予想通りtlp-1の発現が阻害されていた。続いて、let-19及びdpy-22の変異体でのtlp-1の発現を調べると、いずれの場合も非対称性が失われ、T.a.細胞及びT.p.細胞の両方で発現していることが明らかとなった。さらに、lin-17とlet-19の共欠損では、let-19欠損の場合と同様のtlp-1の発現パターンを示すことが分かり、let-19がWntシグナルの下流で機能していることが明らかとなった。また、ほかの細胞系列では、let-19またはdpy-22を欠損しても、tlp-1の発現パターンに変化は見られなかった。 次に彼らは、let-19及びdpy-22とWntシグナルとの関係をさらに調べるために、Pn.p細胞の融合について解析を行った。Pn.p細胞は腹側で前後軸に沿って配列する11個の細胞P1.p〜P11.pを指すが、このうち前側の2細胞、後側の3細胞は細胞融合を起こし、残った中央の6細胞が陰門前駆細胞を形成することが知られる。また、bar-1と呼ばれる遺伝子はβカテニンをコードし、細胞融合を抑制するLIN-39/Hoxの発現の維持に働いていることが知られる。そのため、bar-1の変異体では、異所的な細胞融合が起こり、結果として陰門前駆細胞の減少が見られる。彼らはlet-19及びdpy-22の変異体では、細胞融合の頻度が減少することを示すとともに、これらの変異はbar-1変異体の表現型、つまり異所的な細胞融合を抑制することを明らかにした。また、let-19の変異はlin-39変異体の表現型を抑制できないことなどから、let-19及びdpy-22はlin-39/Hox遺伝子の発現を抑制していることが示された。彼らは、内胚葉誘導やDTC細胞の形成など、Wntシグナルが関与するほかの現象についても調べたが、let-19及びdpy-22のWntシグナルへの関与は、T細胞及びPn.p細胞に限定されていることが分かった。 また彼らは、let-19及びdpy-22の遺伝子構造の解析も行い、これらの遺伝子がそれぞれ哺乳類におけるMED13及びMED12のホモログであることを明らかにした。MED13及びMED12は転写制御複合体の構成成分で、様々な遺伝子の転写活性化または転写抑制に関与していることが知られる。哺乳類では、CRSP及びARC-Lと呼ばれる2つの転写制御複合体が知られており、CRSPは主に転写活性化に働くのに対し、MED12やMED13を含むより大きなARC-Lは転写抑制に働くと考えられている。彼らは、LET19及びDPY-22が転写制御複合体を構成する他の成分、SUR-2/MED23やLET-425/MED6とin vivoで結合していることも免疫沈降などの実験で明らかにした。これらのことから彼らは、線虫においてもこのような2種類の転写複合体が存在し、LET-19やDPY-22はARC-L様の抑制型転写制御複合体を形成していると考えている。 これらの結果から彼らは、LET-19及びDPY-22は転写制御複合体の構成因子であり、Wntシグナルの標的遺伝子の発現を抑制することで、T細胞の非対称分裂や、Pn.p細胞の細胞融合を制御するモデルを提唱している。T細胞では、Wntシグナル非存在下ではLET-19及びDPY-22が機能しTLP-1の発現を抑制しているが、Wntシグナル存在下では転写制御複合体からDPY-22及びTLP-1が放出されてCRSP様の活性型となり、TLP-1を転写活性化する。これにより、T.a.細胞とT.p.細胞の間に非対称なTLP-1の発現が生じる。Pn.P細胞の融合の場合も同様に、Wntシグナル非存在下ではLET-19及びDPY-22がlin-39/Hoxの転写を抑制しているが、Wntシグナルによりlin-39/Hoxが転写活性化され細胞融合が抑制される。そもそもWntシグナルやWntシグナルへの感受性がどのように制御されているのか解明が待たれるが、今回の研究で、Wntシグナルがある種のスイッチとして機能し、転写制御複合体の構造を変化させることで、標的遺伝子の転写活性化を行うメカニズムが明らかになったことは非常に興味深い。 |
|||||
 |
|||||
 |
|||||
LET-19及びDPY-22が転写制御複合体の構成因子として機能し、Wntシグナルの標的遺伝子を転写抑制するモデル |
|||||
|
|||||
[ お問合せ:独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター 広報国際化室 ] |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |