| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2005年12月16日 |
クローンマウスの歴史は1997年、当時ハワイ大学で研究を行っていた若山照彦氏(現CDB、ゲノム・リプログラミング研究チーム)らの成功に遡る。彼らは卵丘細胞の核を未受精卵に移植し、世界で初めて体細胞クローンマウスの作成に成功した。しかし成功率は低く、核移植のタイミングや卵細胞活性化の方法、核ドナーに用いる細胞種など、様々な検討が行われてきたが、体細胞クローンマウスの成功率が約2%を上回ることはこれまで無かった。 今回、ゲノム・リプログラミング研究チームの岸上哲士研究員、若山照彦チームリーダーらは、核移植後の卵細胞をヒストン脱アセチル化酵素の阻害剤であるトリコスタチンA(TSA)で処理することで、クローンマウス作成の成功率が約6%にまで向上することを明らかにした。彼らは、TSA処理によって胚盤胞への試験管内発生率が向上することや、NT-ES細胞の樹立成功率が向上することも示している。この研究成果は、Biochemical and Biophysical Research Communications 誌に12月9日付けでオンライン先行発表された。
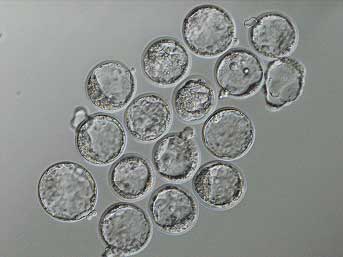
なぜ体細胞クローンの成功率は低いのか。それは、移植された体細胞の核が上手くリプログラムされないことと関係している。分化した細胞では、染色体の特定の位置が活性化または不活性化されて、その細胞種に特徴的な遺伝子発現が実現している。通常の受精では、精子と卵子は高度に分化した細胞であるにもかかわらず、これらの細胞が融合すると核の情報がリプログラムされ、改めて新たな一個体を作りだすことが出来る。しかし、人為的に体細胞核を卵細胞に移植した場合、この核のリプログラミングが上手く行われず、結果として発生に異常をきたすと考えられている。このような染色体の状態を制御しているのは、DNAのメチル化やヒストンのアセチル化と考えられているが、受精に伴ってそれらがどの様に再編成されるのかはよく分かっていない。 若山らは以前の研究で、未熟な精子である円形精子を用いて人工受精を行った場合、受精後の2倍体核で過剰なDNAメチル化が起きるが、これは受精直後のTSA処理で防げることを明らかにしていた。彼らはこの知見を元に、TSA処理することでDNAの異常なメチル化を抑制し、クローンマウスの成功率を改善できるのではないかと考え、今回の一連の実験を行った。 彼らはまず、卵丘細胞を核ドナーに用いた実験で、様々な濃度とタイミングでTSA処理を行い、核移植を行った卵子が試験管内で胚盤胞にまで発生する確率を調べた。すると、核移植後の卵細胞活性化から10時間に渡って5nMのTSAで処理した場合に効果は最も高く、TSA処理をしない20%に対して75%まで発生率が向上することが分かった。これは、DNAの過剰なメチル化は卵細胞活性化後10時間以内に起きているという以前の結果とも整合していた。続いて彼らは、神経幹細胞や尻尾の線維芽細胞、脾臓のリンパ球を核ドナーに用いて同様の実験を行い、いずれの場合もTSA処理によって胚盤胞までの発生率が大きく向上することを明らかにした。 そこで、TSA処理を行ったクローン胚が個体にまで発生する確率を調べたところ、クローンマウスが生まれる確率が6%にまで上昇することが分かった。これは未処理の場合の約1%に比べ大きな改善といえる。さらに、TSA処理によって生まれたクローンマウスは、胎盤の肥大を除いて、クローンマウスで頻繁に見られる肥満や短命といった異常も特に見つかっていない。一方で、核ドナーに体細胞ではなくES細胞を用いた場合、TSA処理は逆効果となり、クローンマウスは一匹も生まれてこなかった。ES細胞におけるDNAメチル化のレベルは元々低く、核ドナーとして適しており、通常2〜6%の成功率でクローンマウスが得られる。体細胞クローンの場合も、過剰量または長時間TSA処理すると、クローン成功率が低下することからも、メチル化の過剰な抑制は負の効果を与えることを示唆している。 彼らは、TSA処理がクローン胚からのES細胞(NT-ES細胞)の樹立にも効果的であることを示している。TSA処理をしない場合と比べ、TSA処理をして得た胚盤胞からは2〜3倍の効率でNT-ES細胞を樹立できることが分かった。このようにして得たNT-ES細胞は、受精卵を経て得た通常のES細胞と同等で、NanogやOct4といったES細胞マーカーを発現していることも確認された。 体細胞クローンやNT-ES細胞の利用は、絶滅危惧種の保存から拒絶反応のない細胞移植といった幅広い応用への可能性を秘めている。それだけに今回の成果は大きなインパクトを持つが、ヒストン脱アセチル化酵素の阻害が重要な役割を果たしたことも生物学的に非常に興味深い。TSAがどの様にして核のリプログラミングを促進しているのか、そのメカニズムの解明が待たれる。 |
|||||
|
|||||
[ お問合せ:独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター 広報国際化室 ] |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |