| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2007年5月28日 |
高い自己複製能と多分化能を併せ持つ胚性幹細胞(ES細胞)は、医学応用の観点から大きな注目を浴びている。ES細胞を試験管内で培養して増やし、さらに有用細胞へと分化させ、創薬研究や毒性検査、移植医療に利用しようというシナリオだ。既にマウスなどの動物ES細胞では大量培養が可能となり、分化誘導の研究も進んでいる。しかし、ヒトES細胞はその培養過程で容易に細胞死を起すため、細胞数が著しく損なわれてしまうという実用面での根本的な問題を抱えていた。 理研CDBの渡辺毅一研究員(細胞分化・器官発生研究グループ、笹井芳樹グループディレクター)らは、ヒトES細胞を培養した際に起こる細胞死が、Rhoキナーゼ(ROCK)の活性化によって引き起こされていることを発見した。ROCKの阻害により細胞死は大きく抑制され、培養効率が飛躍的に向上することが明らかとなり、ヒトES細胞の大量培養への道が拓かれた。さらに、これまで難しかったヒトES細胞への遺伝子導入や、分散浮遊培養による大脳細胞分化が可能になるなど、複数の技術的ブレイクスルーをもたらした。この研究は上野盛夫客員研究員(国立長寿医療センター病院)らとの共同研究で、米国の科学誌Nature Biotechnologyに5月27日付けでオンライン先行発表された。なお、渡辺毅一氏は現在、カリフォルニア工科大学の研究員。この研究は文部科学省のリーディングプロジェクト「再生医療の実現化プロジェクト」の一環として進められた。
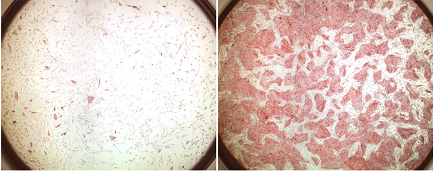
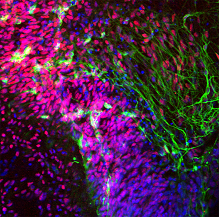
笹井グループディレクターらはこれまでに、マウスやサルのES細胞から神経系や感覚器系の細胞など、医学的価値の高い多くの有用細胞を分化させることに成功してきた。さらに、これらの技術をヒトES細胞へ順次応用し、昨年にはヒトES細胞から、パーキンソン病治療への応用が期待されるドーパミン神経細胞を産生することに成功している。ところが、医学利用のためにヒトES細胞を培養・分化誘導するには、大きな技術的障壁が立ちはだかっていた。ヒトES細胞は非常にストレスに弱く、通常の培養操作でも容易に細胞死を起こしてしまう。例えば、細胞をシャーレからシャーレに植え継ぐ際には、酵素処理によって細胞一つ一つを解離させる「分散培養」が必要となる。しかしヒトES細胞では、この分散培養をすると99%の細胞が2日以内に死滅してしまうため、非効率で特殊な培養技術を使う必要があった。渡辺研究員らはこの問題を解決し、ヒトES細胞の医学応用を大きく促進する技術開発を目指してきた。 彼らは今回、運動神経細胞など一部の特殊な細胞死に関わることが示唆されるRhoキナーゼ(ROCK)に注目して研究を進めた。まず、ヒトES細胞におけるROCKの機能を調べたところ、細胞同士をバラバラにして分散培養すると、直ぐにRhoタンパク質の活性化とそれに続くROCKの活性化が起こることが判明した。そこで、ROCKの選択的阻害剤であるY-27632を加えて培養したところ、ヒトES細胞の分散による細胞死が強く抑制され、単一細胞からのコロニー形成率が約30倍に上昇することがわかった。また、ROCK阻害剤の投与がヒトES細胞の多能性と自己複製能に影響を与えないことや、分散培養以外の培養方法においてもヒトES細胞の生存・増殖を促進することが示された。 彼らはまた、ROCK阻害剤の投与によりヒトES細胞への遺伝子導入が飛躍的に簡便になったことも示している。ヒトES細胞では、ゲノムへの外来遺伝子の導入効率は一般的に0.1%以下と非常に低く、多くの未導入細胞から導入細胞を選別するためには、分散培養によるコロニー形成が必須だった。しかし、前述のように分散培養では細胞死が頻発するため、遺伝子導入細胞を得るには大量の培養が必要だった。今回のROCK阻害剤による細胞死の抑制により、遺伝子改変細胞の作成を10cmシャーレ1枚程度で十分行うことが可能になった。 さらに、今回の方法を用いてヒトES細胞から大脳皮質細胞を高効率に産生することにも成功している。笹井グループディレクターらはこれまでに、マウスES細胞から大脳神経前駆細胞を効率的に産生する方法を開発していた。しかし、その方法は細胞分散や浮遊培養のステップを含むために、そのままヒトES細胞に適用することは出来なかった。そこで今回、この培養系にROCK阻害剤を添加して細胞死を抑制したところ、分散および浮遊培養にもかかわらず生存率は向上し、さらに3つの細胞外シグナル(Wnt、Nodal、BMP)の阻害因子を加えると、培養開始35日後には33%の細胞が大脳神経前駆細胞または大脳神経細胞に分化した。これらの大脳細胞の多くは大脳皮質の前駆細胞であることも明らかとなった。また、培養系にソニックヘッジホグと呼ばれるシグナル因子を加えると、大脳基底核の神経細胞も産生できることが判明した。
今回の研究成果は、ROCK阻害剤の添加という比較的単純な方法によって、ヒトES細胞の生存率を飛躍的に向上させた点で画期的といえる。これにより、ヒトES細胞の培養がマウスES細胞の培養並に容易になったため、1)遺伝子導入が現実的なレベルで可能になる、2)マウスES細胞での分化誘導技術を早期にヒトES細胞に応用できる、3)単一細胞からのコロニー形成によって細胞の品質管理が容易になるなど、もたらされた実用面での効果は計り知れない。笹井グループディレクターは、「今回開発した手法を基盤にして、他機関との共同研究を効率的に進め、ヒトES細胞の医学利用の実現化に向けた開発をさらに加速させていきたい。同時に、なぜヒトESだけが高頻度に細胞死を起こすのか、なぜヒトESでは一般的な細胞死因子とは異なるROCKが機能しているのかなど、基礎面からの研究も進めてきたい」と話す。 |
|||||||
|
|||||||
[ お問合せ:独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター 広報国際化室 ] |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |