| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2008年5月30日 |
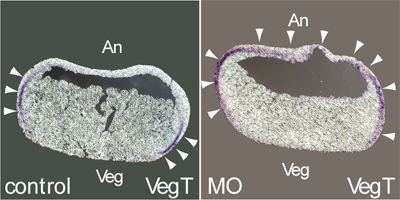
脊椎動物初期胚の発生過程では胚葉形成と呼ばれる細胞の系統分化が起きる。胚葉形成では外胚葉、中胚葉、内胚葉という三種類の細胞集団が形成され、外胚葉からは神経系組織、皮膚組織、感覚組織などが、中胚葉からは筋肉組織、骨格組織、血液組織、結合組織などが、内胚葉からは消化器、呼吸器などがそれぞれ発生していく。胚葉形成は細胞分化のもっとも初期的な段階の一つであり、多能性幹細胞の形成に続いて生体を構成するすべての細胞を産むための基本となるイベントといえる。今回笹井紀明研究員(細胞分化・器官発生研究グループ、笹井芳樹グループディレクター)らは、外胚葉の分化を決定するジンクフィンガー型転写因子XFDL156を同定した。さらにXFDL156が、がん抑制遺伝子であり且つ中胚葉の分化誘導因子として知られる転写因子p53に結合してその機能を阻害することを明らかにした。この研究はCellオンライン版(5月30日付)に掲載される。 初期胚から外・中・内と三つの胚葉が分化するには様々な制御シグナルが関与している。その中でも神経系組織や皮膚組織、感覚組織となる外胚葉分化の制御機構は、分化誘導を決定する分子が未知であるなど、未だ不明の部分が多かった。笹井研究員らは、まずこの外胚葉分化決定因子を同定するため外胚葉化が進んだステージのアニマルキャップ(胚動物極側の中心領域)からcDNAライブラリーを作成した。その中の約2万種の遺伝子に関して、中胚葉分化の初期マーカーXbraに対する発現抑制を指標にスクリーニングを行ったところ、Znフィンガー型転写因子XFDL156という遺伝子が同定された。XFDL156はカエル胚の外胚葉予定領域に強く発現しており、胚に遺伝子導入するとMix.2やXbra、Chordin、Vent1など中胚葉マーカー遺伝子の発現が抑制された。逆にXFDL156をノックダウンすると、中胚葉マーカーの発現が本来外胚葉になる領域にも見られるようになり、この領域で中胚葉分化が進んでいることが分かった。
中・内胚葉誘導分子としてはTGF-βファミリーの一つであるActivinとその下流経路がまず思いつく。しかし、XFDL156はこの経路を阻害して中胚葉化を抑制しているわけではなかった。そこで笹井研究員は他の経路の可能性を探ったところ、がん抑制遺伝子として有名な転写因子p53が中胚葉分化に必要な分子であることが分かった。興味深いことに、XDFL156を過剰発現するとp53による転写活性が阻害され、中胚葉分化を抑制した。さらに詳細に解析を進めたところ、XFDL156はp53に直接結合して、p53とDNAの相互作用を負に制御していることが分かった。XFDL156によりDNAに結合できなくなったp53はMix.2など中胚葉化を促す分子の遺伝子発現を誘導できず、中胚葉分化が抑制されると考えられる。また、p53はアポトーシスを誘導し細胞のがん化を抑制するが、XFDL156はこの機能も阻害することが分かった。XFDL156は発生段階だけでなく様々な場面においてp53の抑制因子として機能出来ることが示唆される。 また、XFDL156と同じ構造を持つ遺伝子が哺乳類にも保存されていることが明らかになった。XFDL156とよく似た構造を持つマウスZnフィンガー型転写因子であるmZfp12とmZfp74が外胚葉に強く発現しており、これらの転写因子はXFDL156と同様にやはりp53に結合して中胚葉化を抑制した。このことから、胚葉形成におけるXFDL156の役割は種間で非常に高く保存されている機能であると考えられる。 今回の研究は、今まで不明であった外胚葉決定因子を同定し、さらにそのメカニズムを解明した点において今後の胚発生研究に非常に有意義な成果である。笹井研究員は今後のこの研究の展開について「多様な機能を持つp53が発生段階でどのように制御を受けるのかも興味深いところ」と語る。p53は細胞死をはじめゲノムの安定性など様々な細胞現象に関わる分子である。p53を制御するXFDL156の詳細な機能解析は、発生現象における新たな知見を見出す重要な手掛かりとなるかもしれない。 また、多能性幹細胞から外胚葉分化の決定機構が解明されたことにより、同じく多能性幹細胞であるES細胞の分化制御機構の解明にも大きな貢献となり得る。ES細胞を再生治療に用いるためには神経や皮膚など特定の組織へと分化させる必要があるが、その分化を完全に制御することは未だ研究段階である。今回の研究を手がかりに、ES細胞から外胚葉、更に神経や皮膚など様々な種類の細胞の分化を効率的に誘導し、治療に応用し得る可能性が広がって行くことが期待される。
|
|||||
|
|||||

| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |