| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2008年12月26日 |
動物の体は細胞で出来ているというのは事実だが、それ以外に忘れてはならない要素がある。それは、細胞同士の隙間を満たす「細胞外マトリックス(ECM; extra cellular matrix)」だ。ECMはタンパク質や炭水化物からなる網目構造で、主に細胞や組織同士を結びつける役割を果たしている。基底膜もECMの一種で、コラーゲンなどの繊維状タンパク質や糖タンパク質で構成され、上皮細胞の足場として機能したり、組織同士を区別する境界線として機能している。基底膜の研究には、線虫C.elegansの生殖巣形成が比較的シンプルなモデルとして用いられている。発生途中の生殖巣の両端には遠端細胞(DTC; distal tip cell)と呼ばれる細胞が存在し、この細胞が基底膜に沿って移動することでU字型の生殖巣が誘導される。DTCの移動にはMIG-17と呼ばれるADAMTS familyプロテアーゼが必要で、MIG-17を欠損するとDTCの移動や生殖巣の形態に異常を生じる。MIG-17は基底膜の分解とリモデリングに関与していると考えられているが、その制御機構の詳細はわかっていない。 理研CDBの久保田幸彦研究員、大蔵清貴研究員(共に細胞移動研究チーム、西脇清二チームリーダー)らは、mig-17変異体のDTC移動異常表現型を正常に戻す2つの復帰変異、let-2およびfbl-1を同定し、これらの遺伝子の相互作用を明らかにした。興味深いことに、これら2つの遺伝子はMIG-17の下流において、それぞれ異なる経路を介してDTCの細胞移動に関与していた。この研究成果は、米科学誌PNASに12月22日付でオンライン先行発表された。
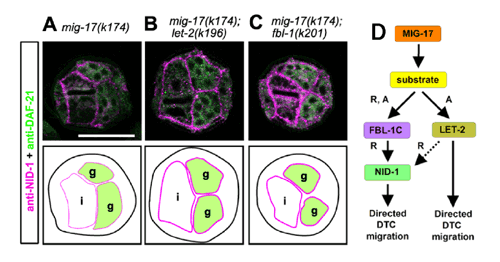
彼らはまず、mig-17変異体をベースに、生殖巣形成に更なる変化を生じる変異体をスクリーニングしていた。その結果、フィビュリン様タンパク質(基底膜分子の一種)をコードするfbl-1に変異が加わると、mig-17変異体の表現型が回復することを明らかにした。また、IV型コラーゲンをコードするlet-2遺伝子への2種類の変異も、mig-17の表現型を回復した。さらに、let-2あるいはfbl-1単独の変異ではDTCの移動に大きな変化は見られないが、両方の変異を同時にもつと、生殖腺の形成に明確な異常が生じることがわかった。このことは、両遺伝子の間に何らかの相互作用があることを示唆していた。 nidogenは通常、基底膜のコラーゲンに結合するため、これらの変異体ではnidogenの局在に変化が起きている可能性が考えられた。彼らが免疫染色を行ったところ、mig-17とlet-2の変異体では、nidogenの基底膜への局在が減少し、fbl-1の変異ではさらにその傾向が強く見られた。そして興味深いことに、mig-17の変異にfbl-1あるいはlet-2いずれかの変異が加わると、nidogenの基底膜への局在が増加することが明らかになった(図A~C)。また、mig-17変異体においてnidogenを過剰発現させると、生殖巣の形態異常が回復することもわかった。これらの結果は、nidogenの基底膜への局在が、mig-17によるDTC移動の制御に重要な役割を果たしていることを示していた。 これらのデータを元に、彼らはMIG-17の下流でFBL-1やLET-2が機能するモデルを示して(図D)。それによると、MIG-17は未知の基質を分解することにより、FBL-1およびLET-2を活性化し、nidogenの基底膜への局在、さらにはDTCの正しい細胞移動を誘導しているという。変異型FBL-1とLET-2は機能獲得型の変異であり、MIG-17非存在下でも活性化状態にある。未知の基質の同定など引き続き研究が必要だが、細胞外マトリックスが器官形成に重要な役割を果たすことが改めて示されたといえる。 西脇チームリーダーは、「ADAMTSプロテアーゼの変異による細胞外マトリックスの変性が多くの遺伝病と関係していることが知られていますが、ADAMTSがどのように細胞外マトリックスを調節しているのかは良くわかっていません」と話す。「今回私たちは線虫の遺伝学を用いて、ADAMTSプロテアーゼの一つであるMIG-17が、基底膜分子を決まった順序で基底膜にリクルートすることにより、器官形成を制御していることを初めて明らかにしました」。
|