| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2010年5月25日 |
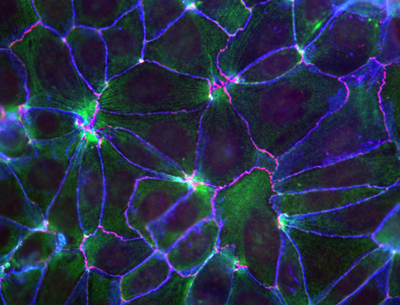
手をつないだ人がそうするように、細胞も引っ張られたら引っ張り返す。腕が抜けてしまったり、引っ張られるがままに引きずられていては、細胞から細胞へと力がうまく伝わらず、組織や器官を正しく構築することができない。上皮細胞においてこの腕にあたるのが、「接着結合」と呼ばれる細胞同士をつなぐ分子構造だ。この接着結合のどこかに、物理的な力を検知し、引っぱり返す機構が備わっているはずだが、その仕組みは明らかでない。 今回、理研CDBの米村重信室長(電子顕微鏡解析室)らは、接着結合を構成するαカテニンという分子に物理的な力を検知する機能があることを明らかにした。αカテニンは接着結合にかかる力の強さに応じて、接着構造をより強固に発達させたり、あるいは緩めているという。この研究成果は、Nature Cell Biology誌に5月9日付けでオンライン先行発表された。
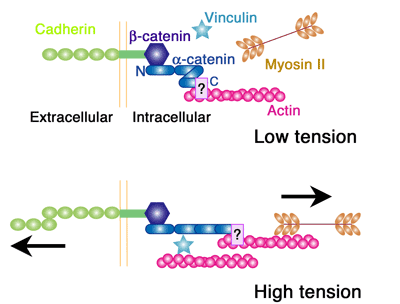
接着結合の中心を担うのはカドヘリンと呼ばれる分子だ。カドヘリンは細胞膜を貫通する形で存在し、細胞の外側で隣接する細胞のカドヘリンと結合して細胞同士を結びつけている。細胞の内側ではαカテニンを含む複数の分子と結合してカドヘリン複合体を形成し、この複合体を介してアクチン繊維と接続している。アクチン繊維は細胞骨格の一つで、ミオシンタンパク質と一緒に働くことで細胞に張力や運動性をもたらしている。カドヘリンは接着結合をつくると同時に、細胞骨格とも連動しているのだ。 米村らはこれまでの研究で、αカテニンとアクチン繊維の両方に結合するタンパク質「ビンキュリン」が、ミオシンIIが力を発生している時だけに、接着結合の位置に集合することを見出していた。これは、ビンキュリンがカドヘリン複合体とアクチン繊維を直接つなぐと同時に、接着結合にかかる張力の検出にも関与していることを示唆していた。そこで今回、彼らがαカテニンとビンキュリンの関係を詳しく調べたところ、αカテニンはその中央部にビンキュリンとの結合部位をもち、その張力依存的な結合はC末端の配列によって制御されていることが明らかになった。
彼らは、αカテニンの部分欠損やミオシンII活性の有無など、様々な条件下で検証を続け、その結果から1つのモデルを提唱している。それによると、カドヘリン複合体に張力がかかるとαカテニンのタンパク質構造が開き、ビンキュリンとの結合部位が露出する。ビンキュリンはαカテニンに結合すると同時にアクチン繊維にも結合するため、カドヘリン複合体と細胞骨格との結合がより強固になるという。つまり、接着結合に力がかかると、それに負けないように、細胞内の接着構造がより強固になるわけだ。 米村室長は、「細胞が物理的な力をどのように検知するのかという疑問に1つのモデルを示せたと思います。今後は、αカテニンの構造変化を実際に観測したり、どれだけの力をかけると構造変化を起こすのかなどを調べ、このモデルをより物理的、定量的に証明していきたいと思います」と話した。
|
|||||||||||||||||||||