| 独立行政法人理化学研究所 発生・再生科学総合研究センター |
2013年4月5日 |
大脳新皮質は知覚や思考、言語など、脳の高次機能を担っている哺乳類に特徴的な脳組織で、なかでも私たち人間のそれはとりわけ大きく発達している。大脳新皮質の各種ニューロンは、脳室帯とよばれる部位の神経幹細胞から生み出され、ある時期から深層投射ニューロン、さらに上層投射ニューロンと、まるでダイヤルを切り替えるように産生する細胞種を転換していく。先に生まれた細胞は深層に、あとに生まれた細胞は表層に配置され、最終的に表面に沿った6層構造を形づくるのだが、発生の段階に応じて産生される細胞種が規則正しく移り変わっていくメカニズムは、これまで不明であった。 理研CDBの隈元拓馬研究員(大脳皮質発生研究チーム、花嶋かりなチームリーダー)らは、マウスを用いた研究から、転写因子Foxg1が大脳新皮質の細胞種の切り替えの最初のスイッチとして働くことを明らかにした。この成果は、オンライン科学誌Cell Reports に3月21日付けで掲載された。
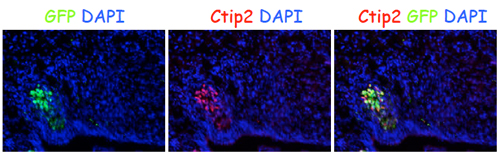
大脳新皮質形成の鍵を握るのはCajal-Retzius(CR)細胞だ。CR細胞は、発生の過程で最初につくられ、最表層にとどまって糖タンパク質Reelin等を分泌し、後から生まれる投射ニューロンの放射状の移動や層構造の形成を誘導するが、大人になる頃には消えてしまう。CR細胞は鳥類や爬虫類では極めて数が少ないことから、哺乳類特有の大きな大脳皮質の形成に貢献していると考えられている。これまでの報告から、CR細胞は大脳新皮質とは異なる脳室帯部位からつくられると考えられてきたが、花嶋チームリーダーらの以前の研究で、Foxg1が深層投射ニューロンの前駆細胞でCR細胞の分化を抑えることを見出したことから、CR細胞と投射ニューロンが共通の神経幹細胞に由来している可能性が示唆されていた。 そこで、隈元研究員らはFoxg1の神経幹細胞の分化スイッチにおける機能を探った。まず、Foxg1ノックアウト(KO)マウスを解析すると、本来CR細胞、深層ニューロン、上層ニューロンが順々に産生され6層構造を成すはずが、KOマウスでは深層,上層ニューロンがつくられず、CR細胞層が肥大化した。また、産生された細胞にGFPを導入して遊走パターンを調べると、投射ニューロンに特徴的な脳室帯側から表層へと向かう放射状の移動がKOマウスでは全く見られなかった。このことから、Foxg1不在下では放射状に移動する投射ニューロンの産生への転換が起こらず、CR細胞がつくられ続けていることが分かった。 次に、彼らはFoxg1の産生細胞種の切り替えにおける役割を詳細に調べるため、Tetシステム(薬剤を投与した期間のみ目的の遺伝子発現をオフにすることができる)を導入した条件付きKO(cKO)マウスを作製した。このマウスで、Foxg1を通常より5日間遅らせた胎生14.5日目から発現させ、産生される細胞を詳細に解析した。すると、14.5日目までの脳ではCR細胞が過剰に産生されるが、Foxg1を発現させるとすぐに深層投射ニューロンの産生が認められた。さらに発生段階が進むと上層投射ニューロンも産生され、最終的にはFoxg1の発現開始を遅らせたcKOマウスでも正常マウスとほぼ同等のニューロンをもつ大脳新皮質が形成された。これらの結果から、Foxg1が産生細胞種を切り替える内在的なスイッチとして働き、CR細胞から各種投射ニューロンへの順次産生を誘導できることが明らかになった。 さらに、彼らはこのcKOマウスを用いて、Foxg1の下流でどのような遺伝子プログラムが作動するかを調べた。Foxg1の発現を胎生14.5日からオンにしたcKOマウスについて、14.5、15.0、15.5、16.5日の大脳新皮質から前駆細胞だけを選別し、マイクロアレイ解析により有意に発現パターンが変化する遺伝子として、新たに多数の転写因子を同定した。特にEbf2/3, Eya2などCR細胞に特徴的な多数の転写因子がFoxg1によって顕著に抑制されることが明らかになった。さらにクロマチン免疫沈降による解析から、Foxg1がこれらの転写因子の制御領域に直接結合しており、その配列は進化的に哺乳類以降で高度に保存されていることが分かった。 これらの研究から、Foxg1が大脳新皮質を構成する多様な細胞種の分化の最初のスイッチとして、重要な役割を果たすことが明らかになった。「今回の研究により、大脳新皮質の形成はCR細胞産生というデフォルトのプログラムを初めに抑制することで、投射ニューロンへの分化が進むことがわかりました。この産生の順番をFoxg1が正しいタイミングで切り替えていくことで、大脳新皮質の最大の特徴である6層構造の形成が可能になったと考えられます」と花嶋チームリーダーは話す。「Foxg1を介した時空間的な細胞種の切り替えシステムは、マウスに比べて進化的に大きな大脳を獲得したヒトでもCR細胞と投射ニューロンのバランスを保つことができる、しなやかで頑強な仕組みであるといえます。私たちを特徴づけるこの大脳新皮質がどのようにしてつくられるのか、今後も探求していきたいです。」
|
||||||||||||||
 |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |