| 独立行政法人理化学研究所 発生・再生科学総合研究センター |
2013年11月25日 |
長い長い旅路の末にようやく自分の持ち場につく、旅人のような細胞がある。腸管の神経をつくる腸管神経系(ENS)前駆細胞はその代表例だ。頚部のあたりで生まれた迷走神経の神経堤細胞は消化管に入ると、増殖しながら消化管壁内を移動し、最終的には腸管全体に行きわたる。この移動には、口側から肛門へ向かう「一次遊走」と、腸管の外側の層から内側の層へと放射状に動く「二次遊走」の2段階があり、その過程では分化・未分化の細胞が共存している。このようなENS前駆細胞の遊走と分化のパターンを制御する分子メカニズムとは、一体どのようなものなのだろうか。 理研CDBの上坂敏弘研究員(神経分化・再生研究室、榎本秀樹研究室長)らは、マウスを用いた研究から、GDNFシグナルはENS前駆細胞の一次遊走、二次遊走の両方に必須であることを示した。さらに、GDNFによって誘導される細胞内シグナルの活性化レベルによって前駆細胞の分化・未分化状態を調整する仕組みを明らかにした。この成果は、科学誌The Journal of Neuroscience にて10月9日付けで掲載された。
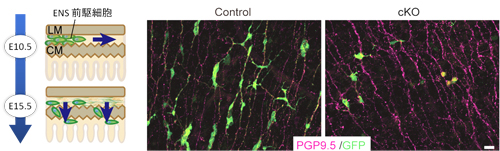
マウスでは、神経堤細胞が胎生9.5日頃前腸に入り、14日頃にかけて肛門側に移動しながら腸管全体を覆っていく(一次遊走)。大部分のENS前駆細胞は腸管筋層で分化し腸管筋神経節(MG)を形成するが、一部の前駆細胞は未分化状態を維持したまま内側の粘膜下層に移動して粘膜下神経節(SMG)をつくる(二次遊走)。一方、GDNFシグナルは消化管の間充組織で発現し、受容体GFRα1に結合してENS前駆細胞が発現するRETチロシンキナーゼを活性化する。GDNFはENS前駆細胞の増殖と遊走に必須であることが知られ、GDNF、GFRα1、RETのノックアウトマウスは腸管神経節欠損症を示す。これまでの研究から、ENS前駆細胞はGDNFに対する感受性を胎児期から出生後まで維持し続けていることから、GDNFがENS前駆細胞に長期間作用し、ENS形成に関わる様々なイベントを統合的に制御するマスター分子である可能性が示唆されてきたが、詳細な機能や分子機構は不明だった。 そこで上坂らは、GDNFシグナルを時期特異的に阻害できるノックアウトマウス(cKOマウス)を複数種類用いて、詳細な解析を行った。GFRα1の発現を調べると、MGでもSMGでも、GFRα1発現細胞(GDNFを受け取る細胞)は未分化神経前駆細胞マーカーSox10を共発現していることが分かった。そこで、一次遊走期の胎生10.5日にGFRα1を欠損させると、対照マウスでは前駆細胞が遊走の先端部でダイナミックに動くのに対し、cKOマウスではほとんど動かないことが分かった。さらに、二次遊走が起こる胎生15.5日に欠損させると、cKOマウスでは遊走が抑制され、SMGはほとんど形成されなかった。これらのことから、GDNFシグナルはENS前駆細胞に作用し、一次・二次両方の遊走を促進することが示された。また、GDNFはENSの発生過程を通して発現し続けるが、シグナルの活性は変化することが知られる。そこでGDNFの発現パターンの変化を調べると、一次遊走期の胎生13.5日には小腸の外側の縦走筋層と内側の輪状筋層で高発現しているが、MG形成が完了している18.5日には縦走筋層での発現はほぼ消失し、輪状筋層でのみ高発現することが分かった。このようなGDNFの活性および位置のシフトが、2段階の遊走を誘導していると考えられる。 ところで、一次遊走と二次遊走の間に位置するMG形成期、腸管筋層にはMGをつくる分化した神経細胞とSMGをつくるために温存された未分化細胞が混在していることになる。このような細胞の分化状態はどのように制御されているのだろうか。MG形成期である胎生12.5日に、ENS前駆細胞におけるGDNFの下流シグナルの活性化レベルを調べると、未分化細胞では活性化レベルが低いのに対し、分化した神経細胞では非常に高いことが観察された。このことは、GDNFによって誘導される細胞内シグナル活性が高まることが、神経分化への引き金となることを示唆していた。そこで上坂らは、多くのENS前駆細胞がまだ未分化である時期にRETを欠損させてGDNFシグナルを遮断した。すると、通常ならば数日後には大半がニューロンに分化するところ、RET欠損細胞では多くが未分化状態にとどまることが判明した。さらに、これらのGDNFシグナルを遮断した未分化細胞にGDNFシグナルを回復させると、遊走と神経分化が再開することも観察した。これらのことから、ENS前駆細胞の未分化状態の維持にはGDNFによる細胞内シグナルの活性化が低いレベルに保たれていることが重要であることが明らかになった。 今回の研究から、たった1つの成長因子が特定の細胞種に長期にわたり作用して、二段階の遊走パターン、細胞増殖、分化・未分化状態の調節という多様な現象を総合的に制御するメカニズムの一端が明らかになった。「このような仕組みはSMG前駆細胞が長い期間未分化状態を維持するためには非常にリーズナブルなシステムですが、反面、GDNFシグナルに対する感受性といった一見すると小さな異常が先天性腸管神経欠損(腸閉塞)のような重篤な疾患を招きかねないという脆弱性も孕んでいます」と榎本研究室長は話す。「ENSの発生機構に関してはGDNFシグナルの他にも多様なシグナルが関与し、それらが協調的に作用していると考えられます。今後は、GDNFシグナルとそれらとの関係についても明らかにしていきたいです。」
|
|||||||||||||
 |
| Copyright (C) CENTER FOR DEVELOPMENTAL BIOLOGY All rights reserved. |