RESEARCH
1.研究の出発点 「舞台装置としての核・染色体の発生制御とその分子機構を理解する」
2.これまでの研究戦略 「DNA複製タイミング制御を切り口に染色体高次構造の発生制御に迫る」
3.今後の方向性 「マウス三胚葉分化直前に生じる条件的へテロクロマチンの分子基盤と意義」
1.研究の出発点 「舞台装置としての核・染色体の発生制御とその分子機構を理解する」
私の専門は分子生物学・発生生物学です。大きな研究目標は胚発生における細胞分化の本質を明らかにすることです。即ち、細胞の未分化状態と分化状態の本質的な違いを明らかにしたいと考えています。
生物の個体発生においては、受精卵が未分化状態から増殖・分化を繰り返して様々な組織や器官が形成されていきます。この複雑な過程をごく単純化して誘導現象や遺伝子活性化の連鎖反応とみなし、その連鎖反応の中の素過程を明らかにしていくのが現代の発生生物学と言えます。このような素過程で働く個々の役者の中でも特に転写因子と呼ばれる遺伝子群が演じる役割の重要性を明らかにしたことは、現代の発生生物学の大きな功績の一つです。
一方で、この枠組みの中では説明の難しい現象も存在します。例えば初期胚発生過程においては、細胞核内部のヘテロクロマチン(転写が不活性で凝縮した染色体領域とその構造)がある時期に増大して染色体の高次構造や三次元的空間配置が大きく変化する例が知られています。哺乳類雌の片方のX染色体が胚発生の初期に不活化されて凝縮してヘテロクロマチン化され、以後安定的に不活化が維持されるのはその好例です。また、受精直後の細胞には備わっていた多能性は発生過程のある時点を境に失われることが知られています。また、両生類胚卵割期には母性因子による制御からzygoticな(胚のゲノムからの)遺伝子発現による制御に移行する中期胞胚遷移 (MBT) と呼ばれる一大分岐点があり、これを境に遺伝子発現制御のみならず細胞周期やDNA複製の様式も大きく変化します。
これらの現象はいずれも、誘導連鎖や遺伝子カスケードの枠組みの中の個々の役者(転写因子等)の振る舞いの変化というよりは、むしろそれらの役者が働く「舞台装置」の変化であるように見えます。ここで言う「舞台装置」に該当するのは核や染色体ですが、実は現代の生物学における核や染色体の発生制御の理解は驚くほど貧弱です。また、このような胚発生初期に起きて以後安定的に維持されるような変化が示唆する所は、未分化細胞と分化細胞の「舞台装置」の本質的な違いです。この違いは、異なる種類の分化細胞同士を比較した場合に見られる差異とは質的に全く異なる可能性が高いと考えます。
4つの転写因子の強制発現がiPS細胞へのリプログラミングを実現したことからも分かる通り、転写因子の重要性は疑いようがない事実です。しかし「舞台装置」の違いは当然「役者」の振る舞いにも違いをもたらします。例えば染色体の側の構造が大きく変われば、それに作用する転写因子の結合様式にも大きな影響が出るはずです。私は、この「舞台装置」の発生制御機構には未解明の問題が多く残されており、ここに細胞分化の隠れた本質が宿るに違いないと考えています。この本質の理解が、細胞分化および細胞リプログラミングをより深く理解する上で重要と考えています。したがって、発生生物学的な視点から核や染色体を研究対象とし、その胚発生過程における振る舞いを調べ、その振る舞いの背後にある機構と意義を明らかにしたい、というのが私の立場です。
このような研究は分子細胞生物学分野の領域としては「核構造とダイナミクス (Nuclear structure and dynamics)」或いは「エピジェネティクス (Epigenetics)」といった範疇に入るかと思いますが、領域としては発生生物学でもあり幹細胞生物学でもあり分野はあってないようなものです。重要なのは、まず自分が研究する価値を見出せるものを明確に認識して研究の大きな方向性を設定し、そこに近づくために実験的にアプローチ可能な問題設定を行い、問題解決に必要な方法論を分野を問わず柔軟に取り入れていく態度であると考えます。また、「エピジェネティクス」というキーワードを使いましたが、いわゆる狭義のエピジェネティックな制御(ヒストン修飾、DNAメチル化等)だけでは全てを説明できない可能性は大いにあると思っています。即ち、既存のパラダイムでは説明できない未開拓の領域があると考えています。そのような未踏の領域に足を踏み入れたいと思っています。
2.これまでの研究戦略 「DNA複製タイミング制御を切り口に染色体高次構造の発生制御に迫る」
やや抽象的な話をしましたが、では具体的にどのような戦略をとっているのかをお話します。この10年間、私は前述のようなことを念頭に置きながら、細胞核内の三次元空間における染色体高次構造(M期のというよりは間期の染色体構造ですが)とその発生制御に興味を持って研究してきました。ポストゲノムの現在もなお染色体高次構造のような基本的かつ重要な研究課題が未解決の状態にあるのは驚きですが、染色体の微細な領域に焦点を絞ることは技術的に可能だがこれだと全体像が見えず、かといって全体像を俯瞰できるような解析法は存在しなかった、という方法論的な限界が要因と思われます。一方、染色体高次構造が発生・分化の過程で制御されていることもよく知られており、その発生制御には何らかの生物学的意義があると考えられますがこれも未解明の問題です。このような状況を打開するには、分子生物学的アプローチによる染色体高次構造の数値化と発生生物学的アプローチの両方が必要ですが、研究開始当初も今も、そのような視点を併せ持つ人は少ないように思います。
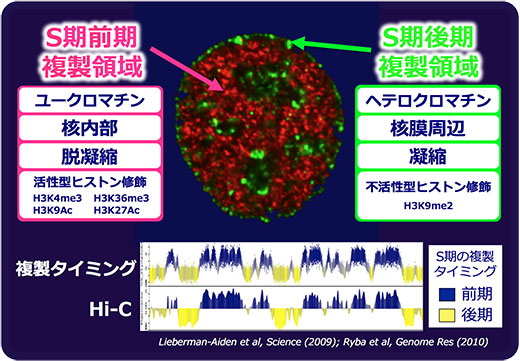
このような状況の中、我々はDNA複製タイミング制御という新しい側面からアプローチすることでこの難問に迫ることが可能ではないかと考えました。DNA複製タイミングと染色体高次構造の間に関連性があることを細胞生物学的な先行研究が示唆していたからです。即ち、哺乳類細胞の核において(図1)、S期前期(Early S)複製領域(赤)は図に示すようなユークロマチン型の特徴を示します(図1左上)。逆にS期後期(Late S)複製領域(緑)は図に示すようなヘテロクロマチン型の特徴を示します(図1右上)。これらは私が研究を始める以前からDNA複製分野においてはよく知られていました。つまり、3次元空間配置的にもクロマチン凝縮の度合いからも、DNA複製タイミングは染色体高次構造のよい指標であることが示唆されていました。しかし、このような概念の根拠は細胞生物学的な解析が主であり、研究開始当初はDNA複製タイミングがゲノムワイドにどのように制御されているか、あるいはその発生制御がどの程度なのかはほぼ未解明の状態でした。
図1. DNA複製タイミングは染色体高次構造の良い指標である
そこでまず我々は、マウス胚性幹細胞(ES細胞)分化の系を導入し、DNA複製タイミングの発生制御を試験管内で観察することを試み、これに初めて成功しました (Hiratani et al, PNAS 2004)。さらに、試行錯誤ののち、高密度マイクロアレイを用いたDNA複製タイミングの全ゲノムマッピング法を考案、確立することに成功しました (Hiratani et al, PLoS Biol 2008)(図1下グラフ)。このマッピング法を用いてマウスES細胞を神経分化前後で比較した所、分化に伴う複製タイミングの発生制御は予想以上に広範囲に渡ることが明らかになりました。逆に、得られたマップをもとに染色体高次構造変化を予測し細胞生物学的手法 (FISH: Fluorescent in situ hybridization法) を用いて予測の真偽を確かめた所、高い精度で染色体高次構造変化を言い当てることが出来ました (Hiratani et al, PLoS Biol 2008; Hiratani et al, Genome Res 2010; Takebayashi et al, PNAS 2012)。即ち、DNA複製タイミングマップが染色体高次構造の良い数的指標であることが細胞生物学的に実証され、染色体高次構造の発生制御の一側面を定量的に解析することが可能になったのです。我々の発見の後、Hi-Cと呼ばれる染色体高次構造を数値化する新しい分子生物学的手法が考案されましたが (Lieberman-Aiden et al, Science 2009)、驚くべきことにHi-Cと我々の複製タイミングマップは非常に高い相関を示し、この結論を支持しました (Ryba et al, Genome Res 2010)(図1下グラフ)。
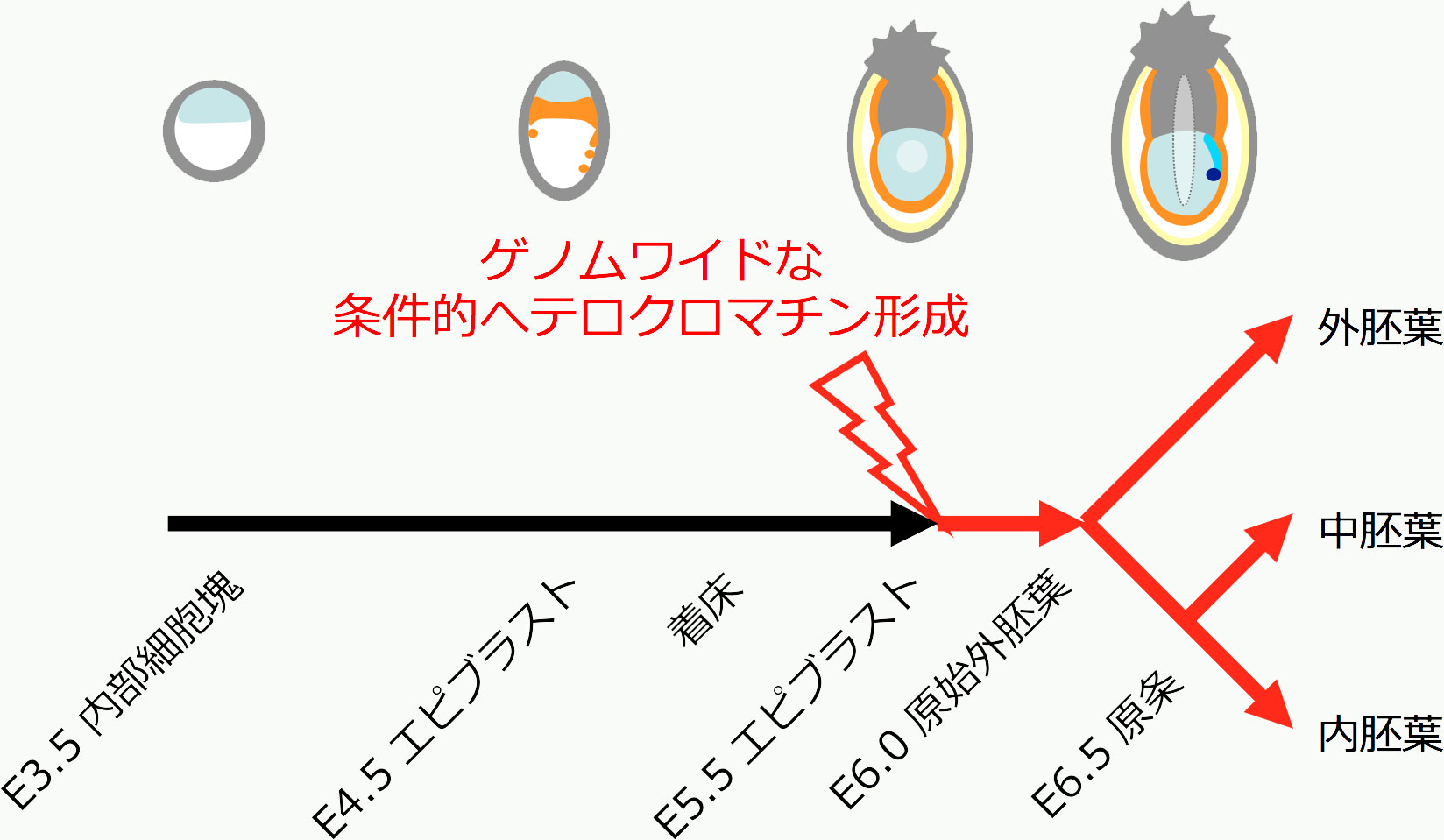
次に、いつどのようにDNA複製タイミングや染色体高次構造に変化が生じるのかを調べる目的で、マウスES細胞分化過程および多数のマウス初期胚発生モデル細胞株を網羅的に調べました。その結果、DNA複製タイミングマップは期待通りに細胞種・発生段階特異的であり、逆にこのマップから細胞種や発生段階をある程度予測することが可能になりました。さらに重要なことに、一連のマップの比較解析から、発生・分化の時間軸上において染色体高次構造が大きく変化する分岐点が三胚葉分化直前の着床後エピブラストの時期に存在することを見出しました(図2上) (Hiratani et al, Genome Res 2010)。変化はゲノム上の広範囲に及び、具体的には次の5つの形質変化が観察されました(図2下)。(1)常染色体上で多くのMb(メガベース)単位の染色体領域がその複製タイミングをS期前期 (Early S) から後期 (Late S) へとシフトさせ、領域内の転写が抑制された [注: これらを以下EtoL領域 (Early-to-Late領域) と呼ぶ]。(2)EtoL領域の核内配置は、複製タイミング変化に伴い核内部から核膜周辺に移行した。(3)EtoL領域は、複製タイミング変化に伴いクロマチンを大きく凝縮させることがFISH解析によって示された (Takebayashi et al, PNAS 2012)。(4)同じ時期に雌の不活性X染色体のDNA複製タイミングもS期前期から後期へとシフトした [注: S期後期への変化は染色体全域のヘテロクロマチン化とほぼ同義] 。(5)エピブラストの分岐点以前の未分化な細胞 [注: ES細胞や着床前エピブラスト細胞] には存在しない核膜周辺ヘテロクロマチン (peripheral heterochromatin) の形成が電顕的に確認された。
S期後期複製、転写不活性化、核膜周辺への再配置、そして凝縮したクロマチン構造は、まさにヘテロクロマチンの古典的な定義そのものです。すなわち、この分岐点においては雌X染色体にとどまらず、ゲノムワイドに条件的ヘテロクロマチンが形成されることが示唆されました [注: 条件的へテロクロマチンとは、発生過程においてゲノム・染色体上に生じる不活性で凝縮した大きな染色体領域のことを指す]。これはマウス胚を用いた古典的な不活性X染色体解析 (Takagi et al, Chromosoma 1982) 及びマウス初期胚の電顕解析の結果とも良い一致を示します (Ahmed et al, PLoS One 2010)。ゆえに、この条件的へテロクロマチン形成はマウス生体内で実際に起きていると考えています。面白いのは、条件的へテロクロマチンの代表例である哺乳類雌X染色体の不活性化と常染色体上のEtoL領域のヘテロクロマチン化が同じ三胚葉分化直前の時期に起こり、両者がよく似た振る舞いを示すことです。その振る舞いの背後にある機構に何らかの共通項があると考えています (Hiratani & Gilbert, Adv Exp Med Biol 2010)。
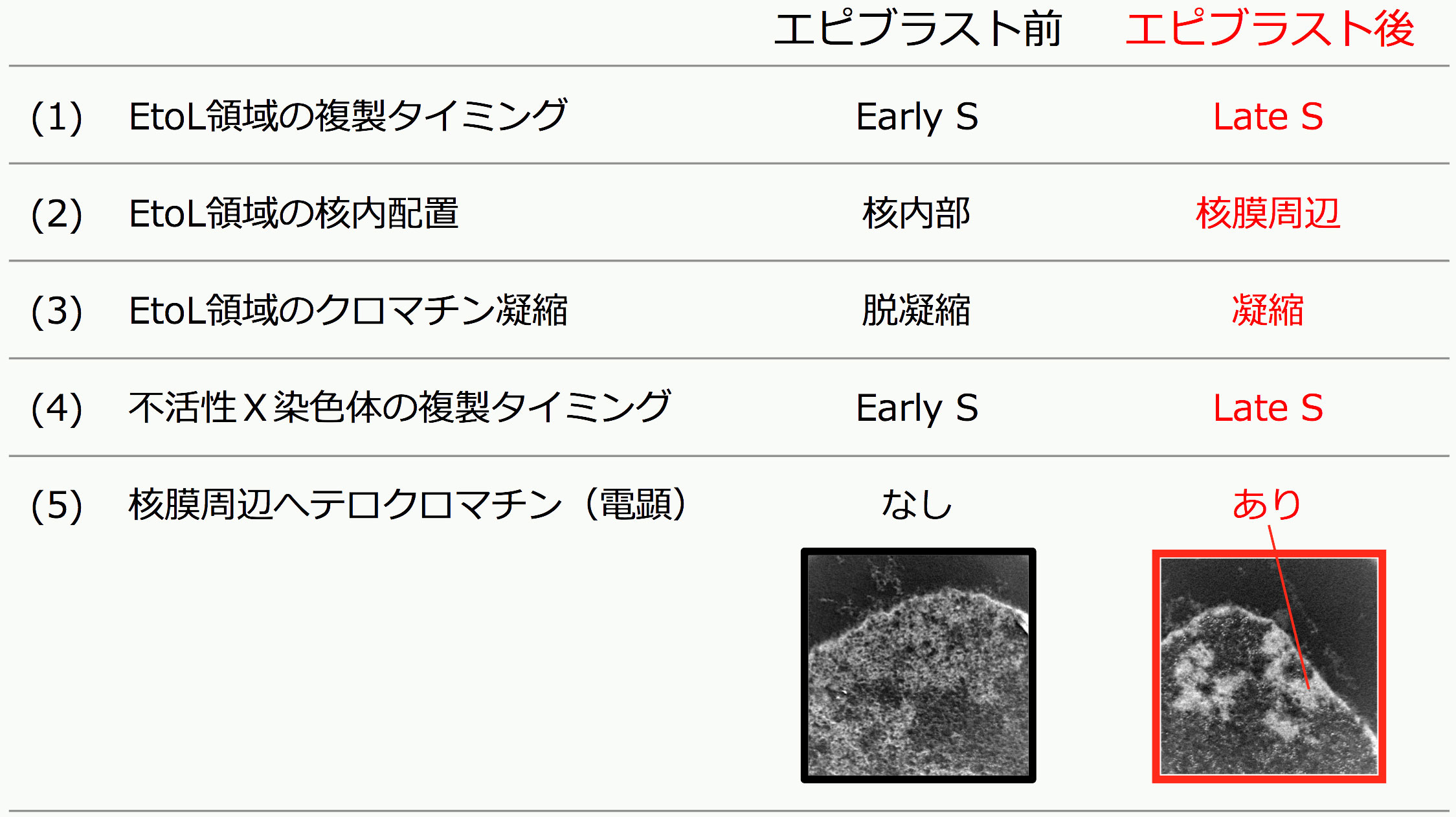
図2. 三胚葉分化直前のエピブラストの時期に染色体高次構造が大きく変化する分岐点が存在する(上図)。この分岐点においては、ゲノムワイドな条件的へテロクロマチン形成が見られ、下図に示す5つの主要な形質変化が核内で観察される [注: EtoL領域はこの時期にEarly-to-Lateに複製タイミング変化する染色体領域のこと]。 また、これらの変化はエピブラスト以後全ての発生段階で安定的に維持される(上図、赤矢印で示す)。
3.今後の方向性 「マウス三胚葉分化直前に生じる条件的へテロクロマチンの分子基盤と意義」
現在は、前述したマウス三胚葉分化直前の分岐点における条件的へテロクロマチン形成の分子基盤と意義を明らかにすることを目指しています。注目している理由は二つあります。一つ目はこの条件的へテロクロマチンが、形成後は調べた限り全ての体細胞で安定的に維持されているという事実です(図2上)。もう一つはリプログラミングとの関係です。この条件的へテロクロマチンは、iPS細胞では完全にリセットされ形成前の未分化状態に戻っていました。しかし驚くべきことに、リプログラミングの副産物であるPartial iPS細胞 [注: リプログラミングが不完全で多能性を獲得し損なった細胞] ではリセットされておらず、この条件的へテロクロマチンが維持されていたのです (Hiratani et al, Genome Res 2010)。このニ点は常染色体と不活性X染色体に共通しています。さらに、リプログラミング効率(=iPS細胞作製成功率)は、この条件的ヘテロクロマチン形成直後の発生段階で既に体細胞並みに低いことが知られています。即ち、この時期に形成される条件的ヘテロクロマチンは(1)不活性X染色体にとどまらないゲノムワイドな現象であること、(2)三胚葉形成以後の分化細胞全てに共通したエピジェネティックな形質であること、そして(3)細胞の分化状態の維持に密接に関わっていること、が示唆されます。
具体的な研究戦略としては、分岐点直後の状態を反映したマウス培養細胞の系を用いてsiRNAによる遺伝子機能破壊による遺伝子探索法を考案し、この分岐点における染色体高次構造変化(条件的へテロクロマチン形成)に関わる因子の網羅的同定を試みています。そして、ES細胞分化とリプログラミングに対するそれらの因子の影響を調べていきます。現段階で(2013年夏)、興味深い表現型を示す遺伝子をいくつか見出しつつあります。これら複数の遺伝子群がどのように協調して染色体高次構造変化を制御しているのか、今後その全体像が見えてくることを期待しています。また、細胞分化に伴う染色体高次構造変化を個別の染色体領域に絞って詳細な顕微鏡観察によって追跡する必要性も感じています。このことも含め、いくつかの新しいアイディアを温めています。また、現在は主にマウスの培養細胞やES細胞分化の系を用いていますが、将来的にはマウス個体レベルの表現型解析も導入したいと考えています。この三胚葉分化直前の分岐点で何が起きているのかを深く理解することによって、未分化細胞と分化細胞の本質的な違いという基礎生物学的な難問に対する答えが得られる可能性があると共に、リプログラミングの分子基盤の理解という応用生物学的なブレイクスルーにもつながる可能性があると考えています。以上のような作業を長期的な視野に立って進めていくことで、冒頭に記した大きな研究目標である「細胞分化の本質」に迫りたいと考えています。2013.7.31 平谷伊智朗