| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2009年5月18日 |
私たちの体を構成するほぼ全ての細胞は、個体の死と運命を共にする一代限りの存在だ。ただ、一つの例外を除いては。それは、精子と卵子、つまり生殖細胞だ。全ての遺伝情報は生殖細胞を介して次世代へと受け継がれ、生命の永続性と種の保存を保証している。しかし、生殖細胞が誕生するプロセスは、未だ謎が多い。生殖細胞を介した生命継承の仕組みを詳細に理解し、生殖細胞の発生を試験管内で再現することは、生物学における究極の目標の一つだ。 今回、理研CDBの大日向康秀研究員(哺乳類生殖細胞研究チーム、斎藤通紀チームリーダー)らはマウスをモデルにした研究で、生殖細胞の元となる始原生殖細胞の形成に関わる主要なシグナル機構を明らかにした。その原理に基づき、試験管内での培養で、胚体外胚葉から始原生殖細胞を高効率に誘導し、さらに、それらの精巣への移植によって機能的な精子に分化させることに成功した。この研究成果は、米国の科学誌Cellに5月1日付けで発表された。
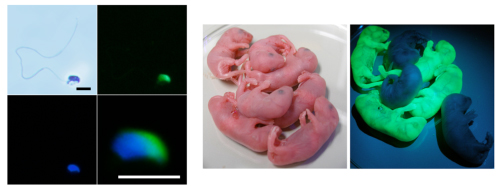
発生6日目頃のマウス胚は、主に胚体外胚葉、胚体外外胚葉、臓側内胚葉と呼ばれる3つの組織から構成される。このうち、主に胚体外胚葉が胚そのものに発生し、他の2つはさまざまなシグナルを発して胚体外胚葉のパターン形成に寄与している。これらのシグナルに応じて胚における組織や器官の位置が決定され、そして生殖細胞も誘導される。これまでの研究で、胚体外外胚葉から発せられるBmp4やBmp8bといったシグナル因子、またその下流にあるSmadなどのシグナル伝達因子が生殖細胞形成に重要であることが示されている。また、斎藤チームリーダーらは、始原生殖細胞の運命決定にはBlimp1とPrdm14と呼ばれる遺伝子の発現が必要で、これらの発現は胚体外胚葉の近位部(胚体外外胚葉と接する部分)の後方で誘導されることを明らかにしていた。 (科学ニュース: 2005.6.8*1: 2007.7.15*2: 2008.6.20*3 ) しかし、Bmp4とBmp8bは胚体外胚葉に接する領域で均一に発現しているため、なぜ胚体外胚葉の後方のみで始原生殖細胞が誘導されるのかは未解明だった。大日向研究員らはこの疑問に答えるために、Smad2とFoxH1と呼ばれる遺伝子に注目した。これらの遺伝子は、胚の前方化を誘導し、後方化の抑制に機能する前方臓側内胚葉の形成に必要で、胚体外胚葉の前後軸に沿ったパターニングに関与することが知られている。彼らはSmad2とFoxH1を欠損した胚を作成し、実際にこれらの遺伝子の制御下で、前方臓側内胚葉が胚体外胚葉の前方でBlimp1の発現を抑制していることを示した。 次に、フィーダー細胞や血清が存在しない条件下で、6日目胚の組織培養を行った。胚から胚体外外胚葉と臓側内胚葉を取り除き、胚体外胚葉のみを培養したところ、BMP4の添加によってほぼ全ての細胞がBlimp1陽性に誘導されることがわかった。この結果は、6日目胚の胚体外胚葉の全ての細胞が始原生殖細胞への分化能をもち、その分化にはBMP4が必要十分な機能を担っていることを示している。また意外なことに、BMP8bの添加は、始原生殖細胞マーカーであるBlimp1、Prdm14、APのいずれの誘導にも必要でなかった。 それでは、BMP4と同じく胚体外外胚葉から分泌されるBmp8bは何をしているのだろうか? 彼らはまず、Bmp8bをノックアウトすると、異常に肥厚した前方臓側内胚葉が形成され、BMP阻害因子であるCer1の発現が亢進することを見出した。そこで、6日目胚から胚体外外胚葉を切除して臓側内胚葉と胚体外胚葉を培養すると、BMP4だけを添加してもBlimp1の発現は誘導されないのに対し、Bmp8bも一緒に添加すると胚体外胚葉にBlimp1陽性の細胞が出現した。これらの結果は、Bmp8bが、前方臓側内胚葉の胚体外胚葉に対する前方誘導活性を適切なレベルに抑制し、胚体外胚葉の後方にBMP4が作用できる領域を形成することで、Blimp1の発現誘導に間接的に寄与していることを示していた。 彼らは、試験管内で誘導したBlimp1陽性細胞の機能解析も行っている。まず、Blimp1以外の始原生殖細胞マーカーも発現していることを確認し、さらに、始原生殖細胞に特徴的なヒストン修飾、DNAメチル化酵素の発現抑制といったエピジェネティックな性質についても生体内の始原生殖細胞と同様の性質をもっていることを示した。次に、始原生殖細胞としての機能を検討するために、誘導したBlimp1陽性細胞を生殖細胞をもたない新生マウスの精巣に移植したところ、精子に分化する能力をもっていることがわかった。この精子を正常な卵子と細胞質内精子注入法によって受精させると、正常に発生し、生殖能力をもつ正常なマウスが誕生した。 今回の研究は、哺乳類の胚発生において生殖細胞が誕生するプロセスを、シグナル機構のレベルで解明するとともに、それを試験管内で再現し、胚体外胚葉から機能的な生殖細胞を誘導することに初めて成功した。斎藤チームリーダーは、「胚体外胚葉は胚をつくる多能性幹細胞です。そのため、今回の知見はES細胞やiPS細胞といった多能性幹細胞にも応用できる可能性があります。将来、倫理的制約を厳密に課した上で、これらの幹細胞から生殖細胞を誘導することも技術的には可能になるかも知れません。この研究が、生殖細胞発生の謎に迫るとともに、生殖医療の研究などにも役立つことを期待しています」、とコメントする。
|