Overview
細胞、組織、器官がそれぞれの特異的機能と特徴ある形態を獲得する過程を理解することは、発生生物学における中心的課題です。数十年来の研究から、遺伝子発現の違いが細胞や組織の機能的分化を確立する仕組みが明らかになってきましたが、どのようなプロセスで細胞形態や組織構造が制御され、再構築されるのか、その仕組みについてはあまり分かっていません。細胞形態の決定において細胞骨格の変化が中心的役割を果たすことや、個々の細胞の形態変化が組織構造全体の構築に寄与することが概してわかってきましたが、その根底にある分子的、力学的メカニズムは不明瞭です。当研究室では、上皮組織の形態形成過程で細胞形態を制御する新規細胞メカニズムの同定を目指し、さらに局所的な細胞形態変化が近傍の細胞群に力学的に影響し、組織全体の構造を形成していく仕組みについて追究します。長期的には、個体内や近隣種間で異なった組織形態形成を呈する形態的多様性の起源と進化を概念化するために、組織形態形成を司る分子的、力学的原理を包括的に理解することを目標としています。
 |
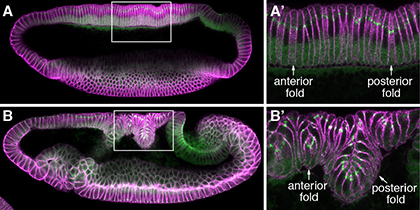
Fig. 1 動物発生は、パターン形成と組織形態形成の2つのイベントから成り立つ |
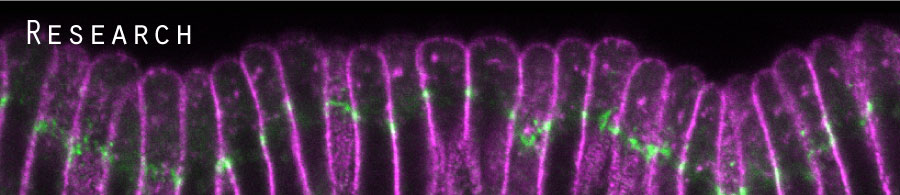
ショウジョウバエ初期胚発生過程では、背側に2つの上皮折りたたみ構造(Dorsal Fold)が形成されます。私達は、この上皮折りたたみ構造の形成を開始し、その構造を形作っていくメカニズムについて研究しています。以前、当研究室では、背側上皮の2箇所の細長い領域における頂端-基底極性の変化とアドヘレンスジャンクション (AJ) の移動が、非古典的な上皮折りたたみ形成の開始メカニズムであることを明らかにしました。 さらに、2つのDorsal Foldの形成開始プロセスは同様ですが、最終的な折りたたみ構造の深さは異なっており、そのサイズはAJとそこに繋がる細胞骨格の間の物理的結合強度の違いに関連していることを明らかにしました。私達は、上皮細胞極性の変化が細胞形態を制御する仕組み、局所的な力学的プロセスが組織全体の構造を決定する仕組みを理解することを目指し、最先端のイメージング技術と多様なショウジョウバエ遺伝学的手法を組合わせ、研究を進めます。
|
Fig. 2 上皮背側折りたたみ構造(Dorsal fold)形成 |
上記の主な研究内容に加え、上皮形態形成研究に関する新規解析ツールを開発するため、また、概念的な視野を広げるために、以下の共同研究も進めています。 1) コンピュータサイエンティストDr. Zia Khan (University of Maryland, College Park)との長期的領域横断的共同研究で、ダイナミックな上皮形態形成における幾何学的変化と構造的変化を定量的に解析するための4次元画像解析ツールを開発しています。 2) 進化発生学者Dr. Steffen Lemkeと共同で、ある進化的系統において特有な創発的形態構造の進化の歴史に関する研究をしています。 成体の器官や体の一部にはならないけれども、発生過程において一過的にのみ、しかし必ず形成される構造の機能を理解することを目指します。
 |
Fig. 3 EDGE4D:画像処理、細胞形態3次元レンダリングと細胞トラッキング |
Project 1: 極性による形態の彫刻
細胞極性の局在変化は、どのように上皮の屈曲を組織するのだろう?
複雑な上皮組織構造の形成は、主に細胞形態の変化によって起こります。これまでに研究されてきた多くの上皮折りたたみ構造形成過程の初期に起こる細胞形態変化は、活性化ミオシン(非筋細胞分子モータータンパク)制御下でのアクチンネットワーク収縮に由来した、細胞表面近くの細胞骨格ネットワークの再構築に深く関連しています。 しかし、近年、私たちは、上記のようなミオシンに依存する仕組みとは異なった、上皮折りたたみ形成の開始に関する新しいメカニズムを特定しました。 具体的には、ショウジョウバエ原腸陥入時、背側に2つの上皮の折りたたみ構造(Dorsal Fold)が形成されますが、この上皮の折りたたみ形成は進化的に保存された極性分子Par-1の翻訳後の発現減少に依存していることを発見しました。 細胞極性は様々な細胞の機能的分化に非常に重要であり、動物の発生過程で多くの組織の幾何学的パターン形成の基礎となっていますが、私たちの発見は、細胞極性の局所的な変化と、組織の折りたたみ構造形成を開始する上皮の頂端-基底軸に沿った不均一な細胞形態の変化の関連を示した初めての報告です。 概念的に言うと、組織の中で局所的に異なった細胞極性調節が、組織上の力学的なバランスを変化させ、上皮組織の折りたたみ形成を組織化している可能性を示しています。
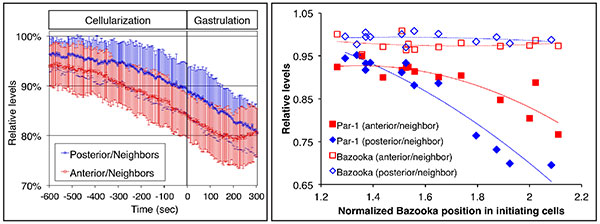
Fig. 1 背側折りたたみ構造(Dorsal fold)形成開始時におけるPar-1減少
(左図) グラフは原腸陥入前後の時間に沿った、開始細胞内と近隣細胞内のPar-1発現レベル比(開始細胞/近隣細胞)を示す。Par-1レベルはGFP標識されたPar-1のライブイメージングにより定量した。開始細胞では、原腸陥入開始前に約10-15%減少した。2つのDorsal foldのうち、前側は赤色、後側は青色で示した。
(右図) 各細胞のジャンクション位置をx軸に(頂端面とBazooka位置の間の距離を測定)、開始細胞と近隣細胞におけるBazookaとPar-1の発現レベル比をy軸にプロットしたグラフ。ジャンクションがより基底側にシフトした細胞では、Bazooka相対発現量は一定なのに対し、Par-1相対発現量は減少している。
頂底軸方向の細胞極性構造は、上皮組織を定義する重要な特徴です。 上皮極性の局所的な不均一性に起因する上皮の折りたたみ形成機構は、広い範囲で適用される一般的なメカニズムである可能性があります。この上皮折りたたみ形成過程を組織化する空間的な情報を理解するためには、局所的なPar-1減少がどのように制御されるのかを明らかにすることが重要です。また、Par-1は、進化的に保存された、多くの基質を認識するセリン/スレオニンキナーゼです。従って、極性変化に依存した細胞形態変化や上皮再構成を制御する分子メカニズムを理解する上で、細胞形態制御に関わるPar-1基質タンパク質を同定することが非常に重要です。
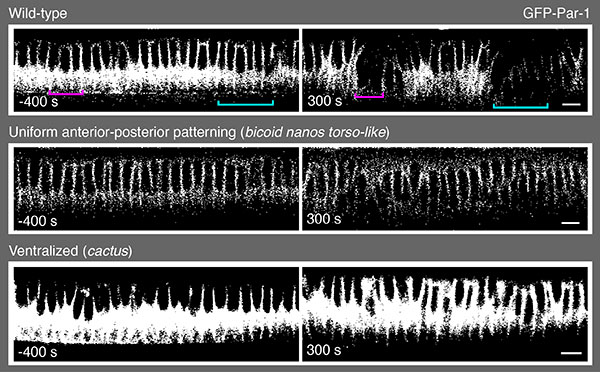
Fig. 2 Par-1減少は、前後、背腹パターン形成システムが特定する位置情報を必要とする。
野生型胚の開始細胞ではPar-1レベルは減少するが(右上, 300秒)、前後パターン情報を欠損した(bicoid nanos torso-like変異体)胚、またはすべて腹側化した(cactus変異体)胚ではPar-1レベルは減少しない(右中と右下, 300秒)。
私たちは以下の課題について、研究しています。
1) Par-1抑制機構において、初期胚パターン形成遺伝子はどのように時間的空間的情報を伝達するのだろう?私たちはこの遺伝子制御回路について、遺伝学的に解析します。
2) Par-1発現減少過程を制御する分子メカニズムとは?Par-1は翻訳後修飾と分解を介して減少する可能性があることから、Par-1減少の原因となるPar-1タンパク内ドメインを構造機能解析により明らかにします。
3) Par-1の減少により、どのように細胞形態が変化するのだろう?プロテオーム解析を行い、Par-1基質を網羅的に検索し、細胞形態を制御する関連基質を同定します。
4) Par-1はBazooka(ショウジョウバエPar-3ホモログ)のPDZドメインと相互作用します。Par-1は分子レベルでどのようにAJ(アドヘレンスジャンクション)の局在を制御するのだろう?私たちは以前、Par-1減少によりAJが基底側に移行すること、そしてこれは細胞形態の変化を開始する重要な現象であることを示しました。(詳細はProject2)
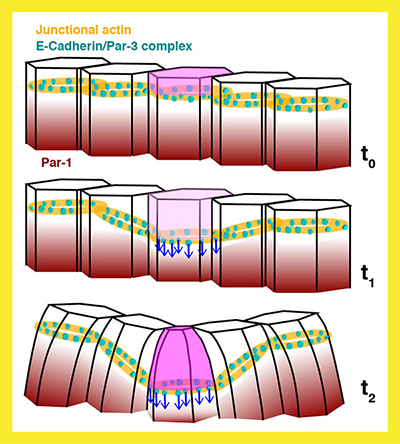 |
Fig. 3 「Par-1依存的な極性変化による、背側折りたたみ構造形成開始の制御機構」を示すモデル図 |
Project 2: ジャンクションの移動
ジャンクションの基底側への移動は、どのように細胞形態の変化を引き起こすのだろう?
私たちは、以前、AJ(アドヘレンスジャンクション)の基底側への移動は、細胞形態の変化を開始する非常に重要な現象であることを発見しました。まず、細胞の形態変化に先立ち、AJは細胞基底側へ移動します。このAJ移動は、Par1減少に伴う、Bazooka/Par1比の増加に応答している可能性があります。 Bazooka(細胞膜裏打ちタンパク質)は特異的にAJに局在するPar-1の基質タンパク質として知られ、そこで AJの構築を制 御します。従って、細胞極性変化を介して細胞形態を変化させる仕組みの解明には、Bazooka/Par-1比の変化がどのようにAJの位置変化を導くのかを理解することが重要な手がかりとなります。 続いて、AJが基底側へ移動した後、細胞の頂端-基底軸に沿った不均一な細胞形態の変化が起こり、最終的には細胞の尖端は収縮して細胞は縦方向に短くなります。しかし実際にどのように、AJ移動が頂端側の細胞形態変化を引き起こすのかはわかっていません。 考えられる可能性のひとつは、AJの移動が、力学的特徴を異にする頂端面と基底-側面の膜表面間で力学的な不均衡を生み出す、という仮説です。 このモデルでは、ジャンクションが2つの異なる膜表面間の境界を規定し、ジャンクションの既知の機能である、上皮細胞の接着と統合性を維持する構造的な機能に加え、形態形成に関する機能もあることを示しています。私たちは以下の課題について研究しています。
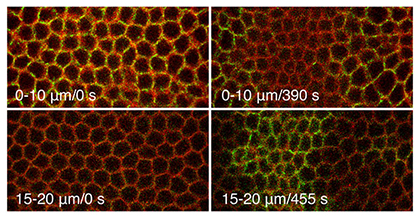 |
Fig.1 Dorsal fold形成が進む間、開始細胞のジャンクションは基底側へ移動する |
1) AJの移動はジャンクションのターンオーバーの加速を伴うのだろうか?ジャンクション移動時のターンオーバー速度をFRAP(Fluorescent Resonance Energy Transfer)により検証します。
2) 1)とは異なり、AJの移動は、細胞骨格ネットワークにより生じる力学的影響を伴うのだろうか?AJはアクチンフィラメントや微小管と関わっています。そのため、ジャンクション複合体が細胞骨格自身または関連するモータータンパクにより引か(押さ)れることで、AJが基底側へ移動する可 能性があります。この可能性を調べるため、アクチン/微小管ネットワークの阻害実験を行い、またそれら細胞骨格系の動きを制御する分子を検証します。
3) AJ移動時の頂端面と基底-側面の膜表面の力学的状態を測定できないだろうか? 上述のように、このような測定は、AJの基底側への移動が、頂端部の形態を変化させる 仕組みを理解するための、重要なヒントになります。私たちはレーザーアブレー ションを使用し、頂端膜内に働く張力を明らかにします。また、組織上の横方向の力学的分布を可視化するため、FRET(Fluorescence Resonance Energy Transfer)を利用した張力センサーを構築します。
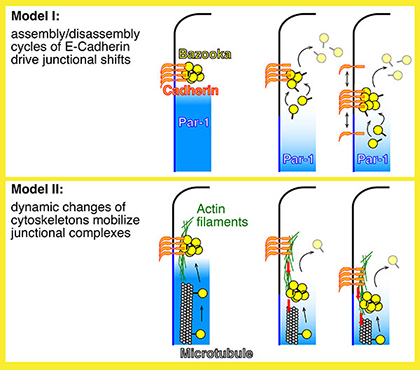 |
Fig. 2 AJ基底側移動メカニズムにおける2つの仮説 |
Project 3: (非)結合と陥入
AJとアクチンネットワークの結合強度が陥入程度を制御する仕組みとは?
上皮組織の折りたたみ形成は、限られた範囲内の’開始細胞’(=組織の屈曲の起点となる細胞群)の形態変化から始まり、その後、その’近隣細胞’と一緒に陥入を続けます。開始細胞が形態変化する形態形成開始時に、近隣の細胞群には形態変化がみられないため、これら近隣細胞の陥入は開始細胞に影響された受動的な動きであると考えられてきました。私たちの実験モデルであるDorsal Foldは、形成終了時には大きく深さが異なった2つの折りたたみ構造になります(図1)。しかし、初期の形態形成は双方ほぼ同様に進む(Par1減少>ジャンクション移動>細胞形態変化)ことから、私たちは近隣細胞の陥入程度の制御機構に関して、近隣細胞の特性に違いがある可能性、さらに近隣細胞と関わる能動的なプロセスが存在する可能性を考えています。このように、2つのDorsal Fold陥入過程の近隣細胞の相違に関する研究を進めており、近隣細胞の陥入過程を司る分子的、力学的メカニズムに着目する点で独創的です。
当研究室では、近隣細胞の陥入程度の違いを制御するメカニズムを模索していますが、αCatenin活性を抑制すると、双方のDorsal Foldで大規模な(深い)陥入が起こることがわかりました。α-Cateninは、AJ主要構成分子とアクチンネットワークを繋ぐ分子架橋として機能するので、このデータは、AJとアクチンの結合が弱い時には大きく陥入し、 逆に結合が強い時には陥入が制限されることを示唆しています。 以前からα-Cateninの不活性化はジャンクションを不安定化し、上皮組織の崩壊を招くことが示されてきましたが、最近は、この細胞間接着における統合性保持機能に加え、α-Cateninの形態形成における新たな機能も証明されつつあります。さらに私たちはα-Catenin依存的なプロセスを介し、Rap1(small GTPase)の活性状態の違いが、近隣細胞の陥入程度を制御することを報告しました。以上から、次の課題に取り組んでいます。
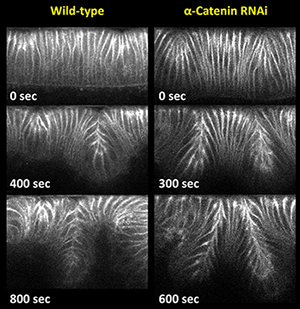 |
Fig. 1 a-Cateninの消失により陥入が大きくなる |
1) α-CateninはAJとアクチンを物理的に結合しているが、Rap1は、このα-Cateninの機能にどのように影響するのか?この課題は、α-Catenin の構造的、機能的特性に関連しており、まず、陥入レベルを調節するα-Catenin内領域を決定します。この結果をもとに、α-Catenin依存的にAJ-アクチン結合を制御するRap1の効果分子を同定します。
2) α-Catenin依存的なAJ-アクチン結合は、どのように近隣細胞の生物学的、物理学的特性に影響し、陥入レベルを制御するのだろう?この結合プロセスを可視化するため、FRET-分子センサーを利用したイメージング方法を開発する予定です。また、陥入する(/しない)近隣細胞の幾何学的情報を得るために、定量的4Dイメ ージング解析を行う予定です(詳細はProject4)。
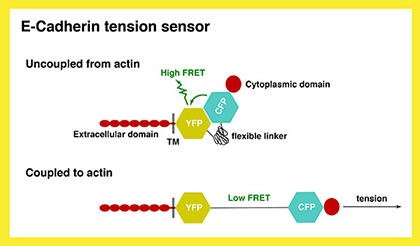 |
Fig. 2 E-Cadherin張力センサーの模式図 |
Project 4: 四次元目に迫る
定量的4Dイメージングソフトウェアの開発と製作(Dr. Zia Khan, University of Maryland, College Parkとの共同研究)
複雑な形態形成過程をより詳しく観察し理解する上で、タイムラプスイメージングデータを使用した細胞動態の定量的3D解析は、非常に有用な手法です。しかしながら、このような解析は、イメージングデータ固有のノイズにより技術的に容易ではないため、当研究室は、コンピュータサイエンティストDr. Khanとの共同研究で、画像処理を行うソフトウェアの開発に取り組んでいます。そして、1細胞レベルでの細胞形態の幾何学的特徴、AJ位置、タンパク濃度の定量的解析、セグメンテーション、3Dイメージのレンダリングの自動化を可能にしました。このツールにより、免疫蛍光標識された固定サンプルを対象にしたコンフォーカル顕微鏡z-スタック画像の自動3D定量解析が可能です。
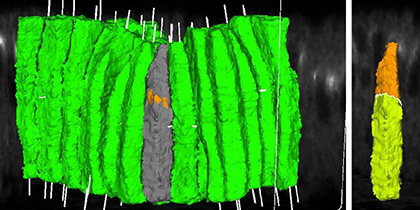 |
Fig. 1 Dorsal Fold形成開始時の細胞形態とジャンクション位置の3Dグラフィックス |
しかし、上皮形態形成は動的なプロセスであり、時間的次元を含んだ4D画像解析は非常に重要な情報をもたらします。そのため、上述の3D画像処理プログラムに、トラッキング機能を加え、さらにsurface meshとbinary image volume間の二重性を利用する等のアルゴリズムを上乗せし、総合的な実行能力を改良しました。その結果出来上がった新奇なソフトウェア、EDGE4Dにより、膜を標識した混み合った細胞集団の動きを、信頼性高く、体系的に解析出来るようになりました。
私たちは、さらにイメージング技術とコンピュータ技術の両面からEDGE4Dのロバストネスと正確性を改良します。すでに幾つかのゴールを達成したこの共同プロジェクトは、今後も上皮形態形成研究における定量的ライブイメージング解析の自動化とさらなる精度の改良を目指し継続していきます。
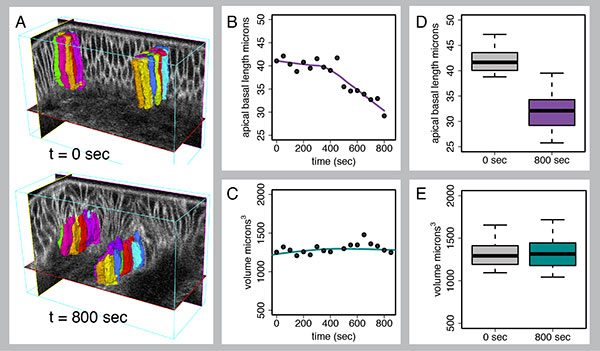
Fig. 2 EDGE4DによるDorsal Fold形成の定量的4D解析
Dorsal Fold形成時の、開始細胞の高さと体積を解析。二光子励起顕微鏡で細胞膜と核を標識した胚のZスタックとタイムラプスを撮り、EDGE4Dで画像処理した。4Dスタックを構築し、開始細胞の認識、再構成、追跡を行った(A)。
開始細胞の高さを測定し(B, D)、これまでの観察と同様に、開始細胞の高さはかなり短くなることが確認された。一方、細胞体積は一定に保たれ(C, E)、開始細胞は不均一に形態変化している間も体積保存の原則に従うことを指している。
Project 5: 美しく儚いもの
一過的な形態発生構造の発生的機能と進化的創発性 (Dr. Steffen Lemke, University of HeidelbergとDr. Zia Khanとの共同研究)
主な組織形態形成は、最終的に体の一部や器官になる複雑な構造を形成します。しかし、形態形成過程の組織構造の一部には、一過的にのみ形成され、その後、周囲の組織構造に取り込まれて消えてしまうものがあります。このような一過的構造の形成、その後の消失という事実から、次の重要な疑問が提起されます。まず、なぜ、このような構造が形成されるのでしょうか?さらに、これらの構造には、何らかの機能があるでしょうか?とある構造が、一過的にのみ出現し、最終的に器官や体の一部にならないのであれば、この構造はどのように進化の過程で創発し定着したのでしょうか?さらに、仮に、形態形成過程は、組織における”基底状態"からさらに”高度な状態"への変移である(概念的には運命決定により前駆細胞が細胞分化する過程と類推)と考えた場合、形態形成状態の逆転は、ある意味、組織状態の”脱分化"として考えられないでしょうか?もしそうならば、どのような細胞特性や力学的特性が基底状態や発達状態を決定し、どのような分子特性がそのような組織状態の逆行的変移を可能にするのでしょうか?これらの疑問は、このような可逆的な形態形成過程を概念化することの困難ながらも興味深い面を強調し、また、私たちの動物発生学と進化論に関する基礎知識には何か盲点があることを示唆していないでしょうか。
Cephalic furrowは上記のような一過的に形成される構造のひとつです。まず上皮に深い明瞭な折りたたみ構造が形成され、その後もとの組織構造の平らな状態に戻ります。原腸陥入の際に形成される他の代表的な2つの構造、ventral furrowとposterior midgutはその後メソダームとエンドダームになりますが、これらと異なり、cephalic furrowは形成後、器官や体の一部になりません。このように、cephalic furrowが常に必ず形成される構造であることは逆説的であり、この形態形成過程は進化の過程において強い自然選択性により影響、維持され、重要な機能を果たす可能性を示しています。Cephalic furrowは、初期胚パターン形成位置や原腸陥入開始時のマーカーとしてよく使われますが、その形成に関わる分子機構はよく分かっていません。また、機能に関しては過去にいくつか仮説が挙げられていますが、それらが詳しく検証されたことはありません。
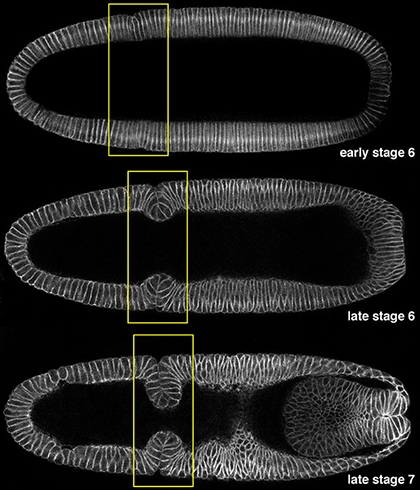 |
Fig. 1 Cephalic furrow形成 |
当研究室では、比較ゲノム学と定量的ライブイメージングを組み合わせ、cephalic furrow形成に関する力学的、機能的、進化的課題について研究します。
1) Cephalic furrow形成の開始にはどのような分子機構が関わっているのだろう?
ライブイメージングを用い、cephalic furrowの細胞形態変化に先立って起こる、細胞内変化を明らかにします。
また、細胞タイプ別にトランスクリプトーム解析を行い、形態変化開始細胞に特異的に発現している遺伝子を明らかにします。この解析により、cephalic furrow形成を開始し統合する細胞内因子を同定したいと考えています。私たちは、cephalic furrow形成における普遍的なメカニズムを理解することを目指しています。
2)双翅類の進化過程のどの時点でcephalic furrowは創発されたのだろう?古典昆虫発生学によると、進化的に下位の昆虫はcephalic furrowを形成しないことが示されています。私たちもある種の下位双翅類はcephalic furrowを形成しないことを示唆するデータを得ています(未発表)。cephalic furrow形態形成の起源と進化的パターンを明らかにするために、双翅類系統樹の主要系列からいくつかの代表種について発生学的調査を行い、ショウジョウバエcephalic furrow形成に関わる分子過程が、cephalic furrowを形成する他の双翅類間でも保存されているかを検証します。
3)Cephalic furrowの発生学的機能とは何だろう? Cephalic furrowの機能解明に先入観なく迫る上で可能なことの一つは、初期原腸陥入時のcephalic furrow周辺領域の細胞形態変化と全体的な組織の動きをモニターし定量的イメージングを行うことだと考えています。このような実験はlight sheet顕微鏡によるin totoライブイメージングの出現により可能となりました。このシステムを使って、ショウジョウバエ野生型とcephalic furrowが形成されない変異体を比較します。また、ライブイメージングが出来る他の代表双翅類にもこの解析を拡張し、cephalic furrowを形成する種としない種で組織の動きを比較します。
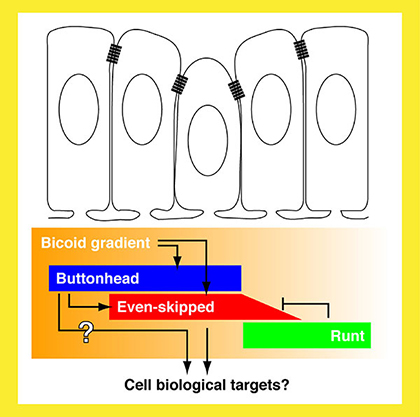 |
Fig. 2 Cephalic furrow形成開始を制御する遺伝子回路 |