| 独立行政法人 理化学研究所 神戸研究所 発生・再生科学総合研究センター |
| 2008年9月30日 |
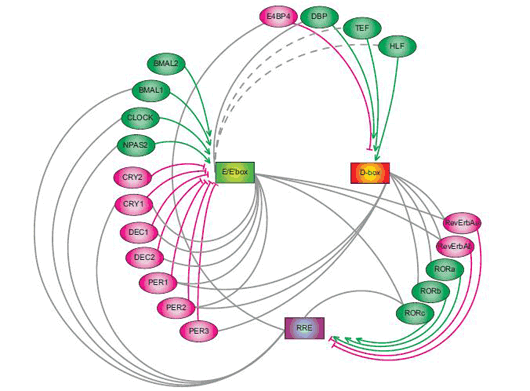
体内時計はバクテリアからヒトまで多くの生物種に保存された生体システムで、ヒトでは睡眠や覚醒、ホルモン分泌を始めとする様々な生理機能を調節している。体内時計の実体は、24時間の周期的な遺伝子発現を繰り返す時計細胞であり、哺乳類の場合、視交叉上核を中心に体の様々な部位に点在している。理研CDBの上田泰己チームリーダー(システムバイオロジー研究チーム・機能ゲノミクスユニット)らは、これまでの研究で、周期的な発現を示す20個の転写制御因子と、朝・昼・夜の発現を指定する3つの制御配列(E/E’box、D-box、RRE)を同定していた。さらに、計算機シミュレーションにより、これらの因子が互いを制御することで周期性を生み出す転写ネットワークのモデルも示していた。しかし、実際の細胞内においてこのモデルが正しいか否かは未解明のままだった。 今回、同研究チームの鵜飼‐蓼沼磨貴テクニカルスタッフおよび同ユニットの粕川雄也研究員らは、マウス由来の培養細胞内に、体内時計の転写制御ネットワークの最小単位を人工的に再構成することに成功した。この系を用いて解析を行なった結果、転写活性化因子と転写抑制因子の発現時期や発現量の組合せによって、様々な時刻の周期的発現が生じることが証明された。この研究成果は、Nature Cell Biologyの10月号に掲載される(9月21日オンライン先行発表済み)。
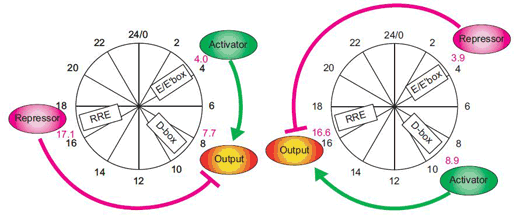
上田チームリーダーは、「体内時計のような動的で複雑なシステムを理解するためには、これまで行なってきたような関係因子の同定や機能解析に加え、‘再構成’によるアプローチが重要です」、と話す。「人工的な再構成によって目的の現象が再現できれば自分達の理解は正しいと考えられますし、逆に再現できなければ何か重要なものを見落としているはずです」。 彼らの示す転写制御ネットワークモデルによると、昼の発現を担うD-boxに結合できる活性化因子をコードする遺伝子は朝配列E-boxをもち、不活性化因子は夜配列RREをもっている。このことから彼らは、朝の活性化因子と夜の不活性化因子の組合せによってD-boxを介した昼の転写が起きる、という仮説を立てた。 彼らはこの仮説を検証するために、活性化因子、不活性化因子、標的配列からなる最小単位の転写制御ネットワークを培養細胞内に再構成することにした。具体的には、人工的な活性化因子としてGAL4-VP16、不活性化因子としてGAL4をプラスミドに構築し、それぞれ朝、昼、夜配列の制御下においたバリエーションを作成した。標的となるレポーター遺伝子にはLucを用いた。これらを、体内時計をもつマウス由来の培養細胞NIH3T3に導入し、Lucの発光をモニタリングすることで、人工転写因子が活性化する時刻と、それによって人工標的遺伝子が活性化する時刻との関係を調べた。 その結果、人工活性化因子を朝に発現させ(E-box)、人工不活性化因子を夜に発現させると(RRE)、Lucの発現が昼にピークを迎えることが明らかになった。つまり、彼らの仮説通り、朝の活性化因子と夜の不活性化因子が、昼の転写を再現するのに必要最小の条件であることが証明された。同様に、昼の転写活性化因子と朝の不活性化因子の組合せによって、夜の転写が誘導されることも示された。さらに、活性化因子と不活性化因子の発現時刻の組合せを変えることで、昼・夜だけでなく、他の時刻にも標的遺伝子の発現が誘導された。実際の体内時計においても、これらの機構によって連続的な発現ピークが生み出されていることが示唆された。
この他にも彼らは2つの仮説を立てていた。一つは、不活性化因子が活性化因子に先行して発現すると標的遺伝子の発現に遅れをもたらし、逆に、活性化因子が不活性化因子に先行すると標的遺伝子の発現が早まる、というものだ。実際にこの理論プロットと、今回の人工転写ネットワークを用いた解析結果は一致していた。もう一つの仮説は、活性化因子と不活性化因子の発現ピークが離れるほど、標的遺伝子の発現振幅の大きさが増加する、というものだ。これについては理論プロットに一致しない実測値が一部みられたが、それらは、活性化因子と不活性化因子の発現量の差が大きい組み合わせであった。そこで、計算機シミュレーションと細胞が内因的にもつ体内時計の転写制御ネットワークを用いて解析を行った。その結果、活性化因子の発現量が増加すると標的遺伝子の発現振幅の大きさが減少し、逆に、不活性化因子の発現量が増加すると標的遺伝子の発現振幅の大きさが増加することがわかった。 今回の研究では、単純な転写制御ネットワークを人工的に細胞内に再構成し、これまで彼らが同定してきた体内時計の転写ネットワークやその設計原理をより詳細に解析した。自然な状態の細胞をみる「リアル」、コンピューターでシミュレーションを行なう「バーチャル」に対して、今回のように複雑な生命現象をシンプルに再構成して検証する方法を「物理的シミュレーション」と呼ぶ。上田チームリーダーは、「物理的シミュレーションでは、現実を精巧に模倣しつつも、より手軽に改変を加え、様々な解析を試みることができます。このようなアプローチは、体内時計だけでなく、動的で複雑な生命現象を解析する有効な手段であり、今後様々な分野で応用されることを期待します」と語った。
|