例えば、ヒトデの幼生の細胞を化学的な処理によってバラバラにすると、幼生は影も形もなくなる。ところが、この細胞を培養すると、やがて細胞が再集合しもとの幼生を形づくる。細胞が互いの種類を選別し、同じ相手と再び寄り添って組織を構築するのだ。これはヒトデに限った現象ではなく、そもそも私たち多細胞生物が成立するには、細胞同士の選別と強固な接着が必要だ。さもなければ、筋肉や骨、皮膚といったほとんどの組織はその形を保つことができず、それぞれの機能が発揮されることはない。
このような細胞の選別と接着はどのようなメカニズムによって成り立っているのか。世界で初めて細胞接着分子の一つ「カドヘリン」を発見し、現在もこの分野をリードする研究者がいる。高次構造形成研究グループの竹市雅俊博士だ。
発見の大きなきっかけは、1974年に留学した米国カーネギー研究所での経験。それまで京都大学で細胞接着の研究をしていた竹市博士は、培養細胞をタンパク質分解酵素の一種、トリプシンで処理すると細胞がバラバラになり、やがて再集合して接着することを幾度となく観察していた。ところが、留学先の研究室で同じように実験をしたところ、細胞がいつになっても再接着しない。トリプシン溶液の組成を調べてみると、カルシウムイオンを強力に取り除く薬品が入れてあることが分かった。「カルシウムを手がかりに、細胞接着を担っている分子が見つかるかもしれない。そう思うととても興奮した」と竹市博士は当時を振り返る。この偶然とも言える経験が、カルシウムイオンの存在下で働く細胞接着分子「カドヘリン」の発見へとつながった。
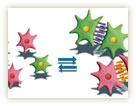
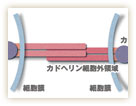
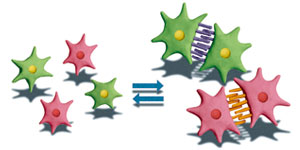
カドヘリンは、細胞膜を貫通する膜タンパク質で、ジッパーのように細胞同士を接着する。現在では、120種類以上ものカドヘリンが知られ、同じ種類のカドヘリン同士が結合することで、細胞が細胞を選別することが分かってきた(図1)。
竹市博士は「カドヘリンは単に細胞同士を接着させるだけではない。細胞や組織がダイナミックに移動する発生過程では、状況に応じてカドヘリンの発現パターンや活性が、刻々と変化するのです」と言う。
例えば、将来脳や中枢神経系をつくる神経管は、本来皮膚になるはずの外胚葉から分離してつくられる。この際、カドヘリンの発現パターンが変化し、細胞配置の再編成が起こるのだ(図2)。つまり、同じ種類のカドヘリン同士が結合するという性質が一つの駆動力となり、細胞集団の分離が起きて新しい器官が形づくられる、という新たな概念が細胞接着の研究から生まれたのだ。
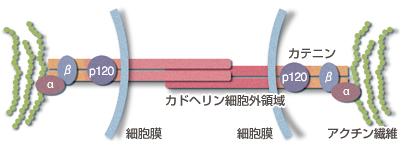
竹市博士が発見したカドヘリンは、「クラシックカドヘリン」と呼ばれ、細胞外で他のカドヘリンと結合すると共に、細胞内ではカテニンと呼ばれる分子と複合体を形成し、さらにカテニンは細胞骨格の一つであるアクチンに作用する(図3)。これは、細胞の形や運動にかかわる細胞骨格が、細胞接着を担うカドヘリンと機能的にリンクしていることを予想させる。竹市博士は「カドヘリンは別の分子との共同作業によって、さまざまな役割を果たしている。こういった別の分子との相互作用が、これからの研究の大きなターゲットとなる」と話す。

最近では、神経ネットワークの形成におけるカドヘリンの機能が注目されている。神経細胞からは、長い「軸索」と、いくつにも分岐した「樹状突起」が伸びている。軸索はシナプスと呼ばれる接合部を介して、別の神経細胞の樹状突起に信号を伝える(図4)。竹市博士は、「シナプスも一つの細胞接着」という考えから、カドヘリンがシナプス形成に働いていると予想し、研究を進めてきた。
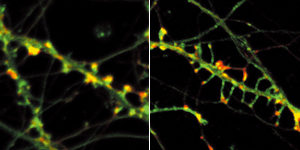
細胞内でカドヘリンを安定化させているαN-カテニンを実験的に操作したところ、αN-カテニンをもたない神経細胞ではシナプスが不安定になり、逆に、αN-カテニンを過剰に発現させると、シナプスが安定化して過剰に形成されることが分かった(図5)。シナプスの安定性は、神経ネットワークを切ったりつないだりという可塑性に直接関わる。カドヘリンはシナプスの安定化を通して、情動や記憶学習にまで関与している可能性が示されたのだ。実際に、ある種のカドヘリンやαN-カテニンをもたないマウスは、聴覚や視覚に障害を起こしたり、不安感を感じにくい、などの異常をもつことも分かってきた。
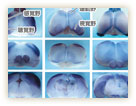
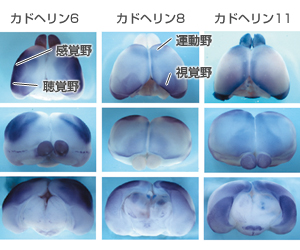
もう一つの発見は、脳の領域ごとに異なる種類のカドヘリンが発現している、ということだ(図6)。例えば、マウスの脳のカドヘリン分布を調べると、共通の機能をもつ大脳皮質領域と神経核と呼ばれる領域は同じ種類のカドヘリンを発現していた。脳は、特定の神経細胞が正しく回路を形成して初めて正常に機能する。カドヘリンは、その接着機能によってシナプスを安定化するだけでなく、ここでも選別能力を発揮し、正しい神経回路を導いているらしいのだ。
カドヘリンの研究は、医学分野にも大きく波及している。多くのがん細胞で、カドヘリンの機能が低下していることが分かってきたからだ。がん細胞の塊がバラバラになり、ほかの臓器に運ばれて増殖するのが転移(図7)。あるがん細胞では、カドヘリンやαE-カテニンが突然変異によって欠損し、別のがん細胞では、カドヘリンがあってもうまく働けない。その結果、細胞接着がゆるくなってしまう。「カドヘリンの制御機構が明らかになり、接着機能を薬剤などにより保つことができれば、がん転移を阻止することも夢ではないだろう」と竹市博士は語る。
竹市博士がカドヘリンを初めて発見してから25年。今、カドヘリンの壮大なる機能が見えてきた。その接着のメカニズムは、多細胞生物の根幹を支えているのみならず、神経回路形成といった動物の高次機能、さらには、がん転移といった病気にまで広がりを見せる。「多様なカドヘリン分子やそれに結合している分子がいったい何をやっているのか、実験結果を見て常に悩んでいる。日々、考えは変わっていく。その中から、これまでにない常識を覆す新しい概念が浮かんでくるのかもしれない」と竹市博士。細胞間の多様で巧妙な「コミュニケーション」に目を向け、深い思考を巡らせるその純粋さは、研究を始めた約40年前も今も、何も変わらない。
一方、ショウジョウバエの気管形成をモデルに、細胞間コミュニケーションのもう一つのかたちを追及しているのは形態形成シグナル研究グループの林茂生博士だ。細胞が体の中を移動し、特定の構造をもった器官がつくられるとき、細胞はどのようにして進むべき方向を知るのだろうか。生きたまま細胞の動きを鮮やかに可視化する「蛍光ライブイメージング」を駆使し、気管の発生メカニズムを解き明かしつつある。
体中に酸素を取り込むショウジョウバエの気管は、興味深い発生様式を示す。気管をつくる細胞は最初の段階でこそ分裂するが、途中からは形を変えたり、相互の位置関係を変えて再配列することのみで管を伸ばしていくのだ。
林博士らは、細胞が伸長しながら再配置されるこの変化を観察したいと考えた。ただし、固定された組織標本による形態変化観察では、本当の動きは分からない。そこで、発光クラゲから取られた蛍光タンパク質「GFP」をつくる遺伝子を導入し、ショウジョウバエの気管細胞だけで発現させ、時間の流れを追って観察することにした。その結果、気管形成のようすを見事に可視化したのだ。
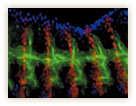
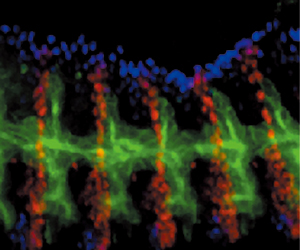
ショウジョウバエの胚ではまず、上皮が体の中へ陥入して袋状の気管原基ができる。この気管原基は左右に10対あり、それぞれが6方向に分岐して気管の形成が始まる。分岐の一つは、表皮の内面に沿って背側へと伸長し、反対側から伸びてきた分枝と中心線上で連結し、左右がつながった管となる。左右からまっすぐに伸びてきて、中心線上で出会い結びつく作業が極めて正確に行われるのだ(図8)。
この過程で、気管細胞は実に複雑な動きを見せる。林博士はこう説明する。「気管は当初、複数の細胞が管の内腔をつくるように配列して接着しているが、一度離れてそれぞれの細胞が相互の関係を把握しながら縦に位置をずらして細長く伸びていく。気管細胞がこのような複雑な再配置を行っている間も、管腔がしっかりと維持されているのだから、なんとも不思議です」(図9)。
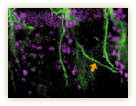
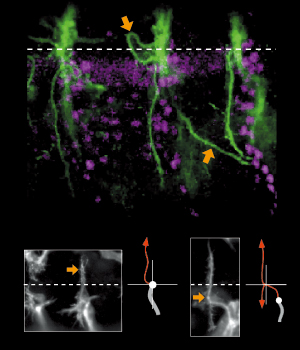
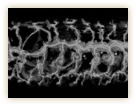
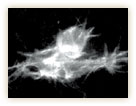
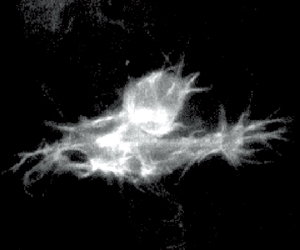
その不思議のメカニズムが何なのか、林博士の研究もさらに進む。気管の微細な形態変化を見ていくと、気管の先端にある末端細胞と呼ばれる特別な細胞が、多数の細かな突起(フィロポディアと呼ばれる)を伸ばしたり縮めたりしながら枝の伸展を先導していくのが分かったのだ(図10)。
GFPによる標識でくっきりと浮かび上がるフィロポディアの微小な動きは、細胞が手探りで進むべき方向を探っているようで、実に美しい。林博士は「ランダムに突起を伸ばして自分の行き場所を探索し、ベストの場所が見つかるとそちらに一歩進む。それの繰り返しで正しい方向へ進んでいくのではないか」と考えた。
フィロポディアは周囲の細胞とのコミュニケーションによって進む方向を決めているのではないか、そのコミュニケーションを担っている分子的実体は何なのか、林博士はそのメカニズムを探っていくことにした。
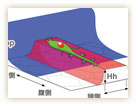
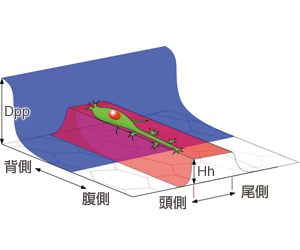
着目したのは、表皮細胞で発現しているヘッジホッグ(Hh)とデカペンタプレジック(Dpp)という2つのタンパク質。Hhは体節ごとにストライプ状に発現しており、Dppは背側の正中線に沿って発現している(図11)。どちらもショウジョウバエの形づくりに大きく関与しているタンパク質だ。気管の末端細胞の動きも、この2つのタンパク質がつくる直行ストライプ模様と何か関係があるのではないか。
HhやDppは、基礎研究が非常に進んでいる遺伝子であり、その発現パターンを実験的に変えることができる。そこで林博士らは、これらの遺伝子をショウジョウバエの体内で、過剰に発現させたり、抑制してみたり、発現パターンを変えたりして、末端細胞の動きを観察した。すると、末端細胞の走行も、発現パターンの変化に伴って大きく乱れることが分かった。例えば、Hhの発現パターンを体節ごとのストライプ状から背側の正中線に沿って前後に走るパターンに変化させると、末端細胞の走行も前後方向にシフトした。また、表皮からのDppシグナルを受け取れないように末端細胞を操作すると、通常では決して正中線を越えることのない末端細胞が反対側へと伸びてしまったのだ(図12)。
これらの結果を総合すると、Hhが末端細胞の進む道をつくり、Dppは誤った方向への進行を邪魔することで、末端細胞を正しい方向へと導いている、というモデルが浮かび上がってきた(図13)。まさに2つの分子が道しるべをつくり、左右からの気管が正中線で出会うように導いているのだ。
さらに、左右からの気管がつながる時には、気管細胞の先端にカドヘリンが輸送されてきて、細胞同士が接着構造をつくり出していることも突き止めた。気管形成ひとつとってみても、なんと見事で精密な機構だろうか。発生のあらゆる現象においても、同じように分子を介した細胞間の巧妙なコミュニケーションが行われているに違いない。
細胞はひとりではいられない。常に周囲とコミュニケーションをとりながら自分の存在を確かめている。メッセージを受け取った細胞は自らもメッセージを発し、他の細胞へと影響を与えていく。生命を形づくるこの分子と細胞の連鎖反応は、厳密性と柔軟性を併せもつ巧妙なシステムであることも見えてきた。個性が調和する細胞社会、そこから私たちが学べることもあるかもしれない。