「テラトーマの中に、初期胚の細胞と同じ何にでもなれる細胞があるに違いない」。1960年代後半、遺伝子研究の幕開けとその発生生物学への応用が予感されるなか、研究者たちは純粋に学問的な興味から、この腫瘍の中に存在するであろう未分化な幹細胞をなんとかして取り出し、意のままに培養したいと考えていた。その背景には、子宮の中にある哺乳類の初期胚はとても小さく見つけにくい上に、ヒトに至っては倫理的な問題からも初期発生を研究するのは極めて困難、という悩みがあった。発生過程を司る物質をとりだして調べるためには大量の胚が必要になる。初期胚と同じ性質を維持する細胞を試験管の中で培養していくらでも増やすことが出来れば、哺乳類の発生研究はめざましい進歩を遂げるだろう。
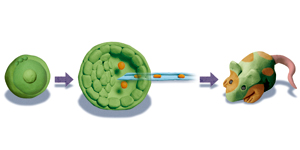
優秀な研究者たちによる試行錯誤の末、1970年にカーンらによってマウスのテラトーマから活発に増殖する未分化な細胞株が樹立され、EC(Embryonal Carcinoma;胚性がん)細胞と名付けられた。期待したとおり、EC細胞は培養皿の上で様々な細胞に分化できることが確認された。この細胞がもし初期胚発生を模倣しているならば、初期胚に戻すと通常に発生を開始するはずである。5年後の1975年、ミンツとイルメンゼーはEC細胞をマウスの胚盤胞(3.5日胚)に注入し、EC細胞由来の組織がモザイク状に取り込まれた「キメラ」マウスを誕生させることに成功した(図1)。ギリシャ神話に登場するキメラはライオンの首と、山羊の胴、蛇の尾を持つ怪物であり、「ふくらんだ怪物」テラトーマによる新たな怪物の誕生といえよう。ここに至って人類は、ほぼ全ての細胞に分化する能力をもった多能性幹細胞を手にしたのだ。
ブレイクスルーはそれだけではなかった。このキメラマウスはEC細胞由来の生殖細胞をもち、EC細胞がもっていた遺伝子を子孫に伝えることができたのだ。ということは、EC細胞になんらかの遺伝子操作を施し、これを初期胚に戻せば人為的に遺伝子を操作したマウスをつくり出せることになる。研究者たちは絶頂感に酔いしれた。
ところが、である。その後、他の研究者によって何度もEC細胞を用いたキメラマウス作成が行われたが、非常に高頻度に腫瘍を誘発するなど、なかなか正常なマウスをつくることは出来ず、またなんとか出来たとしても生殖細胞への分化を起こすことは再現不可能であった。結局、腫瘍組織由来のEC細胞では染色体数や遺伝子発現の異常が高頻度に存在するため、うまく正常細胞に分化できないのであろうということで研究者の見解は一致した。
そこで研究者たちはマウスの遺伝子操作を意図して「正常な」幹細胞を採取しようと試み、EC細胞で培った経験をもとに培養条件を模索し続けた。結果、1981年にエヴァンスとマーチンのそれぞれのグループはマウス初期胚の胚盤胞からES(Embryonic stem;胚性幹)細胞を樹立することに成功する(図2)。ES細胞は「正常」だった。キメラマウスを作成してもテラトーマを形成せず、また生殖細胞に効率よく分化し、次世代に伝わることもできたのだった。
ちなみに、現在ではもう誰一人としてEC細胞を用いてキメラマウスを作成する研究者はいない。しかしEC細胞は、「EC細胞が樹立できたのだから、初期胚からの正常な多能性幹細胞も樹立できるはずだ」という現実味を、当時の研究者に与える重要な役割を果たしたのである。
1989年、カペッキらによって遺伝子ターゲティング法が初めて報告され、狙った遺伝子を「ノックアウト」すなわち破壊することができるようになった。遺伝子を破壊したES細胞を胚に戻すことでノックアウトマウスを誕生させることが可能になったのだ。この手法によって疾患や発生に関係した遺伝子の機能を一つずつ確実に調べることが出来るようになり、マウスES細胞は今や医学、生物学全体に欠かせないツールとなっている。
また研究者たちの当初の目的通り、ES細胞は初期胚を良く反映した細胞であるため、初期胚の中で起きている分子の化学反応を調べる上で都合がいい材料となっている。どの遺伝子のスイッチをオンにするか、オフにするかを決めているタンパク質を転写因子と呼ぶが、ES細胞を用いた研究によって、その多能性と分化方向を司る転写因子の研究も進んでいる。
ところで生物には一般に、程度の違いはあっても体の損傷を修復する能力、つまり「再生」する能力があることはよく知られている。とくに顕著な例では、イモリの足や目を切り取ってもまた生えてくるし、プラナリアをバラバラに切ってもそれぞれが再生し個体になるといった具合である。だが、ヒトにおける再生可能な部位は皮膚など、ごく限られた組織である。もしヒトのES細胞を手にすることができ、それを自在に分化させて損傷部位に移植することができたなら、それが究極の医療となろうことは容易に想像が付く。1995年、再生医療実現を意図したトムソンらはヒトと同じ霊長類のアカゲザルにおいてES細胞を樹立する。続いて他の霊長類でもES細胞を樹立しノウハウを蓄積した彼らは1998年、体外受精に使用された胚のうち余ったもの(余剰胚)の提供を受け、ついにヒトES細胞の樹立に成功した。これによって一気に再生医療への応用可能性が現実味を帯びることになった。
さてES細胞は確かにどんな細胞にでもなれるのだが、果たして腎臓や肝臓などの臓器をつくることも可能であろうか。残念ながら現在の技術では、ES細胞を培養して臓器をつくり出すことは出来ない。胚の中では軸の情報(前後軸、左右軸と背腹軸)、つまり立体座標が与えられるのでES細胞はそれに従って正しく分化し、臓器のような三次元構造を構築できるが、試験管内ではそれが無いために様々な分化細胞の固まりになってしまう。多くの研究者が競って臓器構築に取り組んではいるものの、現在のところはある特定の細胞種に分化させて移植すること、すなわち細胞移植で治療ができる病気に応用の焦点が当てられている。
ではES細胞を用いた再生医療で、具体的にどういったものの実現可能性が高いのであろうか。一つの例はⅠ型糖尿病で、膵臓においてインシュリンをつくるベータ細胞が失われてしまうことが原因であるため、ES細胞を膵ベータ細胞に分化させて移植することが考案されている。
もう一つの例はパーキンソン病である。映画俳優マイケル・J・フォックスもその患者として知られるが、脳のなかでドーパミン(神経伝達物質の一つ)をつくる細胞の不具合によって引き起こされる病気である。この病気に対して移植医療を行った例では、中絶胎児から採取したドーパミン産生細胞を含む組織を患者の脳に移植し、一応の改善がみられている。しかし一人の患者に移植するためは中絶胎児が2体から10体近く必要となるため、倫理的問題もさることながら治療を待つ多くの患者に移植するだけのドーパミン産生細胞を集めることは不可能に近い。
この問題を解決できるのが、無限増殖能をもつES細胞である。2000年、笹井芳樹博士らはマウスES細胞から効率良くドーパミン産生細胞を分化させる手法としてSDIA(stromal cell-derived inducing activity)法を発表し、ES細胞によるパーキンソン病治療実現の道を開いた。SDIA法の概略は、PA6と名付けられた細胞を培養皿に敷き詰め、その上にES細胞を乗せて培養すると一週間ほど経ってドーパミン産生細胞が現れるというものである(図3)。しかしその核となるPA6細胞はもともと、「使いものにならない」細胞として見つかったものだった。
PA6細胞の発見に先立ち、西川伸一博士らはES細胞を血液細胞へと効率良く分化させる細胞として、骨髄から採取した細胞株OP9を発見していた。続いてOP9細胞の分化誘導能を高めようと、その派生株を丹念に調べていくうちに、そのうちのいくつかの細胞株ではどうしてもES細胞は血液細胞へ分化できないようであることに気づいた。人工的な環境で培養を行っているうちに、血液細胞への分化誘導能を失ってしまったらしいと一般的には考えることができる、「使えない」細胞だ。
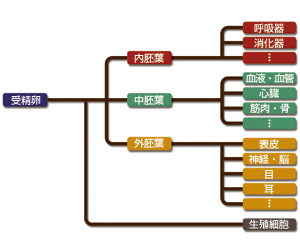
しかし、ここで西川と笹井の両博士は逆転の発想を行う。血液細胞とは発生生物学的には中胚葉系の細胞であることから、これらの派生株はES細胞を中胚葉系以外の細胞へと分化させる能力をもつのかもしれないと考えたのだ。胚を構成する三胚葉には中胚葉の他に内胚葉と外胚葉があり、神経細胞は外胚葉に由来する(図4)。不夜城と呼ばれた研究室で笹井博士らは培養条件の検討を重ねていた。するとある朝、顕微鏡をのぞいた彼らの目に飛び込んできたのは、派生株の一つPA6の上でほぼ全ての細胞からびっしりと生えた神経突起だった。しかも、続く解析によりこれらの神経細胞はドーパミン産生細胞であることが明らかとなる。当時、ドーパミン産生細胞は他の手法ではほとんどつくり出すことができず、パーキンソン病治療に直結すると渇望されつつも研究者たちがその手にすることの出来ない「夢の細胞」であった。
2002年には笹井博士らはサルES細胞においてもドーパミン産生細胞の分化誘導に成功し、現在ヒトES細胞を用いての実験に着手している。

ここで、臨床応用の段階としてES細胞を患者に移植し定着させるためには、いくつかの問題点が指摘されている。特に懸念されているのが、テラトーマの発生である。その高い増殖性と未分化性が特徴のES細胞であるが、未分化なまま成体の組織に移植されるとこれらの特性が災いし、テラトーマを形成してしまうことが知られている。もし分化させたつもりの細胞の中に、1つでも未分化な細胞が混入していると、それを移植された患者には将来的にはテラトーマ発生の危険性があるのだ。テラトーマの研究から現出したES細胞は、出自の原罪を背負うともいえようか。
他家移植にはつきものの移植抗原の問題も指摘されている。ヒトの細胞にはMHCと呼ばれる個人ごとに異なった抗原が存在しており、MHC型の異なる個人へ移植すると免疫反応が起こりその細胞は排除される。この問題を、クローンES細胞を用いることで回避する手段も考案されている。レシピエント(被移植者)の体細胞由来の細胞核を未受精卵に入れて脱分化させ、これを発生させてできた胚盤胞からES細胞を樹立し、移植抗原の完全に一致したいわば「マイES細胞」をつくろうという試みである(図5)。
2004年に韓国ソウル大学の黄教授らが初めてヒトクローンES細胞の樹立に成功したと発表、2005年には同グループが11人の患者から体細胞を採取しクローンES細胞を樹立したとして一躍脚光を浴びたが、後にこれらの論文は捏造によるものであったことが発覚し、新聞やテレビで大ニュースとなったことは記憶に新しい。結局、現時点ではまだ誰も成功していないヒトクローンES細胞の樹立だが、マウスでは可能であることなどから技術的には近いうちに実現するであろう。
一方、技術的に可能であることと、倫理的に実行可能であることは別問題である。クローン胚作製にあたっては多くの未受精卵を使用することが不可避であるし、またこのクローン法を用いなかったとしても、ES細胞を樹立するときにはヒトの胚を壊さなければならず、それが人の生命を損ねることに該当するかどうかという倫理的問題は、世界中で科学者・医療関係者だけにとどまらず哲学者、宗教論者や一般市民を巻き込んでの議論に発展している。現在は多くの国で法整備が整いつつあり、ヒトES細胞の樹立およびその研究は厳しい国家的規制の下に行われている。現時点の日本の法環境では、受精卵からヒトES細胞を樹立することは可能であるが、ヒトクローンES細胞をつくることはできない。
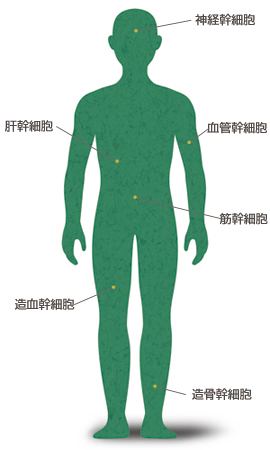
これらの諸問題を回避できるES細胞以外の幹細胞として、成人の体から採取する体性幹細胞が研究されている。既に実用化され最もよく知られているのは造血(血液)幹細胞であろう。この細胞は全ての血球細胞をつくりだすことができ、また将来的に腫瘍を形成することもない。白血病の患者に対して行う骨髄移植では、骨髄バンクにドナー(提供者)登録されているなかから患者と同じ移植抗原をもつものを選んで移植している。 ひと昔前までは再生不可能と思われていた神経に関しても、その再生を担う幹細胞が発見されている。長い間、そのような細胞は高等動物においては存在し得ないと考えられていたが、発見のきっかけは1918年にある鳥類学者が行ったカナリアの研究だった。
カナリアは雄だけが歌うのだが、雌のカナリアも雄性ホルモンであるテストステロンを投与すれば歌うようになることが知られていた。彼は歌う雌のカナリアを詳細に調べた結果、その原因は歌中枢とよばれる脳の一部分がテストステロンの影響で肥大することであることを突き止めたのだ。脳の一部分が増えるということは、成体において神経細胞が増えていることを意味する。「カナリアの神経細胞が増えるのだから、哺乳類の神経も増えるはずだ」。
これにヒントを得て、1992年にマウスで神経幹細胞が発見される。現在この神経幹細胞を用いた脳や中枢神経系の再生医療、特に脊髄損傷の治療に期待が寄せられている。今日ではそのほかにも骨髄由来の多能性をもった幹細胞など、さまざまな成体幹細胞が同定されている(図6)。これらは分化する能力に様々な違いはあるものの、体中のいたるところに新たな細胞の供給源となる幹細胞が存在することは間違いないようだ。
ただ、これら体性幹細胞はES細胞と異なって腫瘍化しない反面、人工的には非常に増殖しにくいという弱点をもつ。あらゆる移植医療において、共通の悩みはドナーの不足もさることながらドナー由来の細胞・組織の不足にある。体性幹細胞の効率的培養法の進展が待たれるところだ。
ここに紹介した様々な細胞は、近い将来において医療を一変させる可能性を秘める。その発見の突破口は、ホルモン処理されたカナリアの脳であり、培養中に変質した細胞PA6であり、怪物とよばれた腫瘍から樹立したEC細胞であった。これらは、純然たる基礎科学的興味に駆られた研究者の手によって、通常の自然界の法則から逸脱して現出した異形の存在であるともいえる。天才と馬鹿は紙一重とはよくいわれるが、論理はそれを突き詰めれば非論理性を呈するほどにこれと表裏一体であり、全ての科学技術は異形とも映る非常識的基礎研究によって裏打ちされているのだ。その非常識の度合いが強いほど、常識的科学技術に与えるインパクトは大きく、ブレイクスルーを生み出す確率が高い。
科学技術研究とは、人類がどこまで世界を理解し操作できるようになれるのか、その到達可能性の検討ともいえる。その意味において常識的研究と非常識的基礎研究は等しい価値をもつべきものであり、いわば車の両輪のようにバランス良く等しい速度で回転することで自然界の理解を深め、こうして得られた理解がさらなる新しい技術や医療を生み出していくのである。