
CDBからのニュース、お知らせを掲載しています。
当センターの笹井芳樹副センター長(52歳)は、2014年8月5日に亡くなられました。謹んでお悔やみ申し上げるとともに、同博士の輝かしい功績をここに紹介します。
笹井芳樹博士(M.D.,Ph.D.)は、脊椎動物の頭部形成や神経誘導の研究から、ES細胞を用いた分化誘導、試験管内組織形成の研究に至るまで、幅広い分野で多大な研究成果を収められました。
ここにその概要を紹介し、笹井博士の功績を称えます。

笹井芳樹 M.D., Ph.D
1. 医療の場から研究の場へ 2. シュペーマンオーガナイザーの分子実体の同定 3. 神経分化に重要な下流因子の同定 4. より複雑な脳の発生に迫る 5. 再現性の高い発生過程 6. 神経発生学のES細胞への応用 7. ES細胞から中枢神経系を誘導するSDIA法の確立 8. ES細胞から網膜色素上皮細胞、末梢神経系ニューロンを誘導 9. 大脳神経組織を誘導するSFEB法の開発 10. SFEB法の応用~視細胞、小脳プルキンエ細胞、視床下部ニューロンの誘導 11. 細胞から組織へ~ES細胞から大脳皮質の自己組織化に成功 12. 立体網膜組織の自己組織化 13. 脳下垂体組織の立体形成 14. ブレイン・メーカー 15. ヒトES細胞の基礎研究への貢献 16. 発生学とES細胞研究、再生医学研究の融合 17. 主要論文一覧 18. 主要総説一覧 19. 受賞歴
笹井氏は1986年に京都大学の医学部においてMDを取得した後、内科医の研修医として医療の現場で働き始めた。しかし、多くの病が生物学的に明らかにされていないことを知ると、神経生物学を研究していた京都大学の中西重忠教授のもとで研究を開始した。中西研では神経発生を含む、多くの発生イベントに重要な役割を果たしている脊椎動物のHes-1およびHes-3を同定した※1。
笹井氏は京都大学で博士課程を得ると、ポスドクの留学先としてアフリカツメガエルの初期発生の研究をしていたUCLAのEddy De Robertis研を選んだ。シュペーマンらによる両棲類を用いた研究により、オーガナイザーが神経を含む背側領域の誘導活性を有することが知られていたが(この功績により、シュペーマンは1935年にノーベル賞を授与されている)、当時、その分子実体は同定されていなかった。1990年代初期は分子生物学の急速な発展がみられ、発生生物学と分子生物学の融合が始まろうとしていた。笹井氏は京都大学で学んだ分子生物学的な手法を用いてオーガナイザーの分子実体を探り、Chordinの同定に成功した※2。さらに翌年、Chordinが神経誘導活性を有することを明らかにした※3。アフリカツメガエルのアニマルキャップと呼ばれる未分化な組織(外胚葉由来の組織で表皮に分化するが、内・中胚葉に分化する能力も保持している)にChordinを過剰発現させると、神経に分化することを見いだしたのだ。また、Chordinの神経誘導活性はBMP4により拮抗されることも明らかとなった。後に、ChordinとBMP4による相互抑制は神経発生だけでなく、背腹軸の決定という発生学の中心的な役割を果たしていることが示された※4。現在では、Chordin-BMP4による背腹軸の決定は、ショウジョウバエから脊椎動物まで種を超えて広く保存されていることが知られている。

留学を終えた笹井氏は、1996年に京都大学に戻り准教授、教授として、さらに2000年から理研CDBのグループディレクターとして神経発生の研究を続けた。Chordinがアニマルキャップを神経化する際に誘導される転写因子を解析し、Zic-r1およびSox2を同定した※5。これらの転写因子は、BMP4によって神経化を阻害すると発現が抑制され、またZic-r1を過剰発現すると神経組織が誘導されることが示された。一方、Sox2はFgfと共に過剰発現させると神経組織が誘導された。さらに、SoxDも神経化したアニマルキャップにのみ発現が認められ、SoxDのドミナントネガティブ(優性阻害)はChoridinによる神経化を抑制することが示された※6。このように、複数の転写因子が協調的に機能することによって神経分化が制御されていることが明らかとなった。
笹井氏らは、神経組織が生じる外胚葉の分化に重要な因子XFDL156の同定にも成功している※7。XFDL156は外胚葉特異的に発現しており、XFDL156の過剰発現は中胚葉の分化を抑制し、逆にXFDL156の抑制は過剰な中胚葉分化を引き起こす。また、XFDL156は中胚葉を誘導するp53に直接結合し、その機能を阻害することを見いだした。
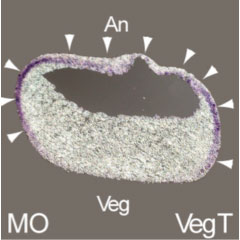
発生初期、オーガナイザーから分泌されるChordinなどによって神経組織が誘導される。その後、発生の進行に伴い神経組織はより細かく領域化され、複雑な脳組織を構成する。脳の発生を知るためには、単純な神経組織から脳が形成される過程を明らかにする必要がある。笹井氏は神経組織の領域化に関わる遺伝子を解析し、複数の重要な遺伝子を同定した。例えば、Tiarinは神経板の前方領域に発現する分泌タンパク質の一種で※8、発生の進行に伴い神経管の背側領域に限局して発現する。Tiarinは神経管の背側領域の形成に必須であり、神経化させたアニマルキャップを背側化することを示した。神経管の背側化に関しては、Jiraiyaも報告している※9。背側化にはBMPシグナルが重要な役割を果たすが、JiraiyaはBMPRII(BMPレセプターII)に直接結合しレセプターの膜表面への輸送を阻害する。従って、Jiraiyaの過剰発現や抑制によって神経管の背側化に影響を与えることが示された。
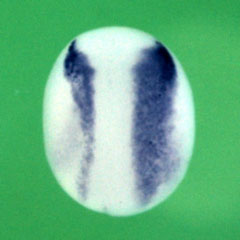
一方笹井氏らは、神経組織の前後軸に関与する遺伝子も同定している。例えば、XsalFの過剰発現は神経組織を前方化することを発見した※10。神経組織の前後軸は主にWntシグナルによって制御されており、Wnt活性が低いほど前方化される。XsalFはWntシグナルの抑制に寄与する因子の発現を正に制御しており、Wntシグナルを抑制することによって前方化を促進していることが明らかになった。また、Del1の過剰発現も神経組織の前方化を引き起こすことを示した※11,12。Del1は分泌タンパク質であり、Ror2シグナル経路を介してWntシグナルを抑制する。従って、Del1の発現が高いところではWntシグナルが抑制され、前方化が促進されることが示された。
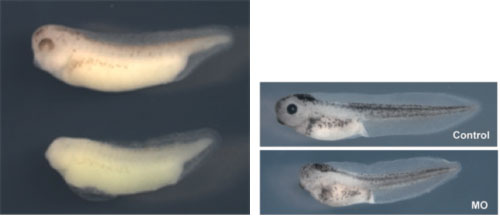
さらに笹井氏らは、中枢神経だけでなく末梢神経に関わる遺伝子群の同定も成功している。FoxD3は、末梢神経になる神経冠細胞の分化に重要な役割を果たしていた※13。未分化なアニマルキャップにFoxD3を過剰発現することにより、神経冠に分化することが示された。さらに、Pax3とZic1が協調的に神経冠の分化に寄与することも示されている※14。
このように、笹井氏はアフリカツメガエルを用いて、頭部の複雑なパターン形成が適切に形作られる過程を明らかにしてきた。さらに、外胚葉由来のアニマルキャップを用いることによって、中胚葉・内胚葉の影響を受けることなく神経組織のパターン形成を明らかにしてきた。
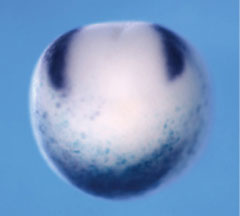
発生過程において、脳などの複雑な組織形成は基本的に間違えることなく正しく進行する。このような、再現性の高い発生過程を保証するためには、発生システムが多少乱れても適切に対応する頑強性が必要である。アフリカツメガエルの背腹軸形成は最も初期のパターン形成であり、その後の発生過程に重大な影響を与える。従って、背腹軸形成は様々な擾乱に対して頑強性を保持していることが知られている。例えば、Chordinの量を多少変動させても背腹軸に大きな影響は現れないが、そのメカニズムは明らかにされていなかった。笹井氏らは、ONT1と呼ばれる分子がChordinの量が多すぎると分解を促進し、逆に少なすぎると分解を抑制することでChordinの量が一定になるように制御していることを示した※15。また、背腹軸パターンは胚の大きさに応じて適切なパターンを形成することが知られている。アフリカツメガエルの背腹軸を半割にすると、背側半割胚から相似形を維持した半分のサイズのオタマジャクシが発生する。このような、胚サイズの擾乱に対する頑強性(スケーリング)は、Sizzledが胚サイズ依存的にChordinの安定性を制御することにより実現していることも示した※16。
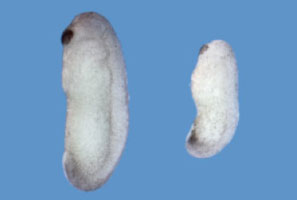
上述のように、笹井氏は主にアフリカツメガエルを用いた研究から、脊椎動物の神経誘導・頭部形成に関わる制御メカニズムを明らかにしてきた。また、多能性を有するアニマルキャップから各種神経組織を試験管内で誘導する方法の構築に成功していた。笹井氏は、このような方法を哺乳類に応用するために、最も高い多能性を保持するES細胞から神経組織を誘導する研究に1998年頃から精力的に取り組んだ。
ES細胞というと再生医学への応用が注目されがちだが、笹井氏は基礎発生学における有用性を強く意識していた。子宮内で発生する哺乳類では、複雑な組織間相互作用を伴う神経発生や脳形成のメカニズムを解析するのは容易ではない。しかし、試験管内でES細胞から神経組織の誘導を試みることで、周辺組織との複雑な相互作用やシグナル入力を排した環境で、脳形成のメカニズムを論理的かつ定量的に探ることができる。これは構成的発生学と呼ばれる新しい分野だが、笹井氏はこの分野を開拓し世界をリードする功績を収めた。
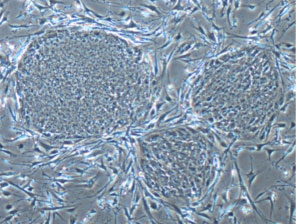
2000年、ちょうど笹井氏が京都大学から理研CDBに移籍する頃、その後の華々しい発展の皮切りとなる論文が発表された。笹井氏らは、マウスES細胞をストローマ細胞(骨髄などで支持組織を構成する細胞)と共培養することで、中枢神経系ニューロンを選択的に誘導できることを発見したのだ※17。彼らはこの方法を、SDIA(Stromal cell Derived Inducing Activity)法と名付けた。この方法では、特にドーパミン産生ニューロンが高効率に誘導され、これをマウスの脳に移植すると、細胞の性質を維持したまま線条体に組み込まれることが示された。この研究成果は、現在京都大学を中心に行われているパーキンソン病(ドーパミン産生ニューロンが変性する疾患)の治療法開発に向けた研究に発展している。
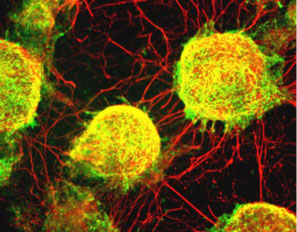
続く2002年、笹井氏らのグループは、SDIA法によって霊長類のES細胞からも、ドーパミン産生ニューロンなど中枢神経細胞を誘導できることを示した※18。さらに興味深いことに、SDIA法によって、中枢神経から派生する網膜組織の一部、網膜色素上皮細胞が誘導できることも発見した。網膜色素上皮細胞の誘導法は、その後10年以上にわたる研究を経て、現在、理研CDBの高橋政代プロジェクトリーダーらが行っている加齢黄斑変性の臨床研究に発展している。加齢黄斑変性は、網膜色素上皮細胞が傷害を受けて視機能が低下する疾患である。臨床研究では、患者iPS細胞から網膜色素上皮シートを作成して網膜下に移植することで、その根本的な治療法の開発を目指している。
笹井氏らは、その後もSDIA法に様々な修飾を試みた。その結果、培地中にBMP4やShhといったシグナル因子を特定のタイミングと組み合わせで加えることで、ES細胞からより広範な中枢神経系細胞や末梢神経系ニューロンまでを選択的に分化誘導できることを明らかにしている※19。
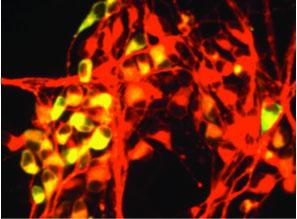
一方、SDIA法を含む既存の方法では、大脳(終脳)神経細胞の誘導はほとんどできていなかった。そこで笹井氏らは、全く新たな培養法の開発にも取り組んでいた。その成果が実を結んだのが、2005年に発表されたSFEB(Serum-free Floating culture of Embryoid Body-like aggregates)法である※20。この方法では、他種細胞との共培養を行わず、ES細胞を「浮遊凝集培養」させることで高効率に神経細胞が誘導され、なかでも大脳前駆細胞を高い頻度で得ることに成功した。さらに、ShhやWnt3aといったシグナル因子を加えることで、大脳皮質や大脳基底核など、大脳の異なる領域組織を選択的に誘導できることも示した。
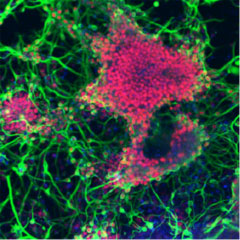
笹井氏らのグループは、SFEB法を修飾したSFEB/DLFA法も合わせて開発し、ES細胞から神経網膜前駆細胞を経て視細胞を誘導することにも成功している※21。網膜色素上皮細胞の誘導には既に成功していたが、視機能に最も根本的な機能を果たす視細胞の誘導に成功した意義は大きい。
また、ES細胞を浮遊培養する際に速やかに再凝集させるSFEBq法を開発し、さらに複数の誘導因子を順次加えて行くことで、小脳プルキンエ細胞の誘導にも成功した※22。脳発生において、小脳は隣接する中脳峡部形成体からのシグナルによって誘導されることが知られる。笹井氏らの実験では、この発生過程をなぞるように、ES細胞からまず峡部形成体を誘導し、さらに培養を続けることで小脳細胞を得ることに成功した。つまり、異なる組織間の相互作用を必要とする分化誘導までも再現したのだ。一方、発想の転換による分化誘導法も試みている。つまり、従来生存に必須であると考えられていたインスリンをはじめとする余分な成長因子・誘導因子を一切含まない条件で培養することによって視床下部ニューロンの分化誘導にも成功した※23。このことは、中枢神経系における発生の基底状態が視床下部を含む前脳であることを意味する。このような組織間相互作用や基底状態を想定する分化誘導を実現するためには、培養条件の徹底的な試行錯誤が必要だった。また、培養条件の同定は、結果として、脳発生のメカニズムに新たな知見をもたらした。
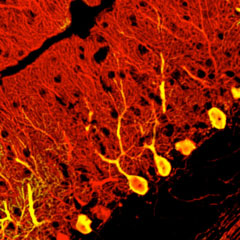
2008年、笹井氏らは、ES細胞の分化誘導研究を大きく次の段階へと進める論文を発表した。先に開発していたSFEB法を応用し、マウスおよびヒトのES細胞から立体的な層構造をもった大脳皮質組織を試験管内で誘導したのだ※24。それまで、生体内で見られるような複雑で立体的な組織を試験管内で構築することは困難だと考えられてきた。しかし笹井氏らは、ES細胞を速やかに凝集させるSFEBq法によって大脳皮質前駆細胞を高効率に誘導し、さらに培養を続けると、自発的に4層の層構造が形成され大脳皮質組織に成長することを見つけたのだ。周辺組織との相互作用なしに、ES細胞が単独で立体的な脳組織にまで発生できるという事実は、世界中の科学者を驚かせた。
2013年には、ヒトES細胞由来の大脳皮質組織を長期培養する方法を開発し、妊娠第2三半期の大脳新皮質に相当する組織にまで成熟して行く様子を観察することに成功している※25。このような、生きた状態でのヒト脳の発生観察は、ES細胞やiPS細胞がなければ不可能なことである。
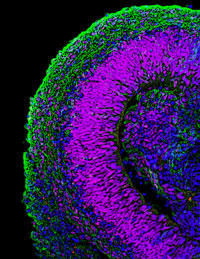
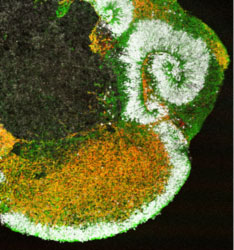
2011年、笹井氏らは、マウスES細胞から立体網膜組織の形成に成功し、自己組織化の研究は大きな発展を遂げた※26。それまでに、網膜色素上皮細胞や視細胞、つまり網膜のパーツを個別に誘導することには成功していたが、立体的で複雑な層構造をもつ網膜組織全体をそのまま試験管内で誘導できたのはこれが初めてだった。彼らは、SFEBq法にいくつかの修飾を加えることで、ES細胞から、神経上皮、眼胞と呼ばれる組織を経て、網膜の元となる眼杯を誘導した。眼杯をさらに長期培養すると、生後の網膜と同様の多層構造をもつ神経網膜にまで成長した。発生学においては、眼杯は水晶体や角膜など外部組織からの物理的作用によって誘導されると長く考えられてきたが、ES細胞を用いた実験では、内在的なプログラムのみによって眼杯の形が形成され得ることが示された。この発見は、さらに、複雑な立体構造の自律的形成の機構の解明についてさまざまな視点からの研究を可能にしており、笹井氏自身は構造形成の力学的研究を開始していた。
笹井氏らのグループは、ヒトES細胞から神経網膜を含む立体網膜組織を誘導することにも成功している※27。眼科は再生医療において期待される分野の一つだが、神経網膜は複雑な層構造をもつため、外から細胞を移植して組み込むのは困難である。しかし、この研究によって層構造をもった網膜組織が入手可能となり、眼科領域における再生医療の可能性を大きく広げた。
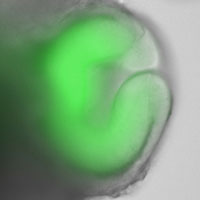
笹井氏らはSFEBq法の修飾により、マウスES細胞から脳下垂体組織の自己組織化にも成功した※28。成功の鍵の一つは細胞の量だった。培養開始時のES細胞数を約10000個に増やすことで細胞塊内のシグナル環境が変わり、視床下部細胞と口腔外胚葉細胞が共に誘導され、それらの相互作用により下垂体の元となるラトケ嚢が誘導された。そこに各種シグナル因子を加えると、副腎皮質刺激ホルモン(ACTH)産生細胞など、腺性下垂体に特徴的な各種分泌細胞が分化した。さらに、下垂体不全マウスに、ES細胞由来の下垂体組織を移植したところ、血中のACTH濃度が上昇し、マウスの活動量や生存率の回復が見られた。脳下垂体は全身のホルモン分泌を制御する中枢組織であることから、その発生を部分的に再現できたことは大きなインパクトをもたらした。
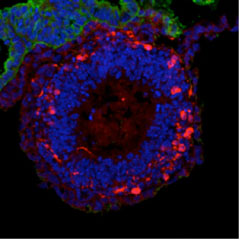
このように、笹井氏らのグループは、ES細胞から脳を構成するさまざまな神経細胞、さらには神経の立体組織の誘導に成功してきた。そのため、Nature誌に掲載された2012年の記事で、笹井氏は「THE BRAINMAKER」とまで称されている。このインタビューのなかで笹井氏は、ES細胞に人為的な操作を加えるのではなく、むしろ人為的な操作をできる限り取り除くことで、ES細胞自身が内在的プログラムに従って分化・自己組織化すると説明している。また、「自分は次々と脳組織をつくってパーツ屋になりたいわけではなく、常に全く新しいことを試みたい」と語っている。多様な神経組織がどのようにして脳という複雑な器官に統合されていくのか―。その疑問にES細胞を用いて挑戦したかったのかも知れない。
笹井氏らは、ヒトES細胞の技術基盤研究においても重要な成果を収めている。その一つは、ヒトES細胞に特徴的な細胞死のメカニズムの解明だ。ヒトES細胞は一つ一つバラバラにして培養すると死んでしまうが、そのことが遺伝子導入や大量培養を困難にしていた。笹井氏らは、この細胞死がRhoキナーゼの活性化によって引き起こされていることを解明し、Rhoキナーゼの阻害によって培養効率が飛躍的に向上することを示した※29, 30。また、将来の再生医学への応用を視野に、動物由来成分を含まない培養法の開発にも取り組んでいた。例えば、SDIA法による神経誘導には動物細胞との共培養が必要だったが、ヒト羊膜由来の細胞外マトリックス成分が同様の誘導活性を持つことを見いだし、動物成分を完全に除去した環境でヒトES細胞から各種神経細胞を誘導することに成功した※31。
また、ES細胞は、シグナル因子など外的刺激を取り除いた状態では、自発的に中枢神経系、なかでも前脳に相当する神経組織に分化することがわかっている。これはES細胞の分化基底状態(デフォルト)が中枢神経系であることを示し、発生学的、進化学的にも非常に興味深い現象である。笹井氏らは、2011年の論文で、Zfp521と呼ばれる遺伝子の発現が、ES細胞の内因的な神経分化の引き金になっていることを明らかにしている※32。
上でも触れたが、笹井氏らは神経発生学の基礎的な知見を基盤に、培養環境中にさまざまなシグナル因子を特定の組み合わせとタイミングで加え、ES細胞から各種神経組織を誘導する培養条件を同定してきた。また、このような培養条件の同定は、神経分化のメカニズムに重要な知見をフィードバックしている。笹井氏らや他のグループによって、ES細胞やiPS細胞から多様な神経組織が誘導できるようになり、応用研究の可能性を大きく広げている。これまで入手困難だったヒトの生きた神経組織を試験管内でつぶさに観察できるようになり、神経発生学や病態研究、創薬などの分野に大きな影響を与えている。さらには、これらの細胞を移植治療に用いる再生医療の研究も急速に進んでいる。
Human Frontier Science Program Organization 10周年記念賞(1998年12月)
ベルツ賞(2006年11月;共同受賞)
文部科学大臣表彰科学技術賞(2009年4月)
東京テクノ・フォーラム21ゴールド・メダル賞(2009年4月)
大阪科学技術賞(2010年10月)
井上学術賞(2012年2月)
6th Sayer Vision Research Lecture (Foundation of NIH) (2012年4月)
塚原仲晃記念賞(2012年9月)
井植文化賞(2012年10月)
武田医学賞(2012年11月)
山崎貞一賞(2012年11月)
System Biology Pioneer Award (SPIE, USA)(2013年5月)
Hans Sigrist Prize 2013 (Hans Sigrist Foundation, University of Bern)(2013年12月)
上原賞 (2014年3月)
科学雑誌、研究機関等による追悼記事を紹介します。
Yoshiki Sasai: stem cell Sensei, Stefano Piccolo, Development
Yoshiki Sasai – a tribute to an outstanding scientist, Mun-Keat Looi, Wellcome trust
Sadness Over the Tragic Loss of Dr.Yoshiki Sasai, ISSCR
In memoriam, Andi M Skilton, University College London (UCL)
TRIBUTE TO DR.YOSHIKI SASAI, Bernard Siegel, J.D., Genetics Policy Institute
Obituary: Yoshiki Sasai, Edward M. De Robertis, Cell
Obituary: Yoshiki Sasai, Arnold R. Kriegstein, Cell Stem Cell
A celebration of the life and genius of Yoshiki Sasai: An obituary, Enrique Amaya, Xenbase